Растворимость веществ в растворителе - это способность вещества растворяться в данном растворителе. Характеристика растворимости играет важную роль в различных областях науки и техники, включая химию, физику, медицину и промышленность. Прежде чем изучать факторы, влияющие на растворимость, необходимо понять, что вещество, которое должно раствориться, называется растворяемым, а растворитель - среда, в которую оно растворяется.
В процессе растворения растворимые частицы взаимодействуют с молекулами растворителя. Растворитель может быть жидким (вода, спирт, растворители на основе органических соединений) или даже газообразным (различные газы в другом газе). Главной особенностью растворителя является его химическая природа и структура.
Факторы, влияющие на растворимость вещества в растворителе, включают следующие:
1. Агрегатное состояние. Растворимость вещества зависит от его физического состояния - твердого, жидкого или газообразного. Наиболее распространена растворимость твердых веществ в жидких растворителях. Например, соль вода - одно из самых распространенных растворов, которые мы употребляем в повседневной жизни. Однако некоторые вещества не растворяются в других органических растворителях, кроме специально подобранных.
2. Физические условия. Растворимость также зависит от физических условий, таких как температура и давление. Многие вещества становятся более растворимыми при повышении температуры, так как это увеличивает кинетическую энергию молекул, способствуя их взаимодействию. Однако есть исключения, например, газообразные вещества, у которых обратная зависимость между растворимостью и температурой.
3. Химические свойства. Молекулярные и ионные связи вещества также оказывают влияние на его растворимость. Вещества могут быть полярными или неполярными, и это свойство влияет на их взаимодействие с растворителем. Например, полярные растворители (например, вода) обычно хорошо растворяют полярные вещества, в то время как неполярные растворители (например, бензол) хорошо растворяют неполярные вещества. Кроме того, наличие химических реакций между растворителем и растворяемым веществом также может повлиять на растворимость.
Что влияет на растворимость веществ в растворителе?

- Температура: В общем случае, с повышением температуры растворимость твердых веществ в воде увеличивается. Однако, это правило имеет исключения. Например, некоторые соли, такие как гексагидраты, растворяются хуже при повышенных температурах.
- Давление: В отличие от температуры, давление обычно практически не влияет на растворимость твердых веществ в жидкости. Исключением могут быть некоторые вещества, такие как газообразные вещества, растворяющиеся в жидкости под давлением.
- Химические свойства: Взаимодействия между веществами также оказывают влияние на их растворимость. Например, вещества с подобными химическими свойствами могут лучше растворяться друг в друге.
- Растворимость других веществ: Существующие в растворе другие вещества могут оказывать влияние на растворимость нового вещества. Некоторые вещества могут образовывать соединения или взаимодействовать с другими веществами в растворе, что может способствовать или уменьшать их растворимость.
- pH: Кислотность или щелочность раствора (измеряемая с помощью pH) может влиять на растворимость различных веществ. Например, некоторые вещества могут лучше растворяться в кислых условиях, а другие - в щелочных.
Для понимания растворимости веществ в растворителе необходимо учитывать все эти факторы и проводить определенные эксперименты или исследования. Это позволяет предсказать и объяснить растворимость вещества в определенном растворителе и использовать это знание в различных областях науки и производства.
Химический состав
Растворимость веществ в растворителе зависит от их химического состава. Вещества могут быть ионными или молекулярными, и эта особенность будет влиять на их взаимодействие с растворителем.
Ионные вещества состоят из заряженных ионов, обычно катионов и анионов, которые притягиваются к противоположно заряженным частям растворителя. Это взаимодействие обеспечивает высокую растворимость ионных веществ.
Молекулярные вещества состоят из нейтральных молекул, которые могут взаимодействовать с растворителем через слабые силы, такие как диполь-дипольное взаимодействие или ван-дер-ваальсовы силы. Взаимодействие молекул с растворителем определяет их растворимость.
Кроме того, другие факторы, такие как растворимость вещества в воде, растворимость при различных температурах и давлениях, а также растворимость в различных растворителях, могут быть связаны с его химическим составом.
- Полярность молекулы;
- Размер молекулы;
- Тип межмолекулярных сил взаимодействия;
- Структура молекулы;
- Наличие функциональных групп и активных центров;
- Свойства растворителя.
Все эти факторы учитываются при изучении растворимости веществ в различных растворителях и позволяют понять, от чего зависит их взаимодействие и растворимость.
Температура раствора
Тепло, добавляемое к раствору, активирует молекулы растворителя и увеличивает их движение. Более интенсивное движение молекул растворителя способствует лучшему контакту с молекулами растворенного вещества, что в свою очередь способствует увеличению растворимости.
Однако, есть вещества, для которых растворимость увеличивается с понижением температуры. Для этих веществ теплота растворения отрицательна, что означает, что их растворимость увеличивается при охлаждении.
| Тип вещества | Влияние температуры |
|---|---|
| Канализационная селитра | Увеличение растворимости с повышением температуры |
| Глюкоза | Увеличение растворимости с повышением температуры |
| Серная кислота | Увеличение растворимости с повышением температуры |
| Гексан | Увеличение растворимости с повышением температуры |
| Карбонат кальция | Увеличение растворимости с повышением температуры |
| Бензоиновая кислота | Увеличение растворимости с повышением температуры |
| Медный сульфат | Увеличение растворимости с повышением температуры |
| Йод | Увеличение растворимости с повышением температуры |
| Хлорид серебра | Увеличение растворимости с повышением температуры |
| Масло | Увеличение растворимости с повышением температуры |
Таким образом, температура раствора является одним из основных факторов, влияющих на растворимость веществ в растворителе.
Давление
При повышении давления, растворимость газообразных веществ в растворителе увеличивается. Это связано с тем, что повышение давления увеличивает концентрацию молекул газа в растворителе, что способствует их более интенсивному взаимодействию с растворителем.
Однако, для растворения твердых веществ или жидкостей в растворителе, давление имеет незначительное влияние на их растворимость. Это связано с тем, что внешнее давление сравнительно мало по сравнению с силой, с которой молекулы вещества держатся вместе.
Таким образом, растворимость веществ в растворителе может изменяться под воздействием давления, однако влияние этого фактора зависит от типа вещества и растворителя.
Распределение электронной плотности
Распределение электронной плотности определяет вероятность нахождения электрона в определенной области пространства. Вещества с высоким распределением электронной плотности имеют большую вероятность образовывать связи с другими веществами.
Как правило, вещества с большим количеством электронов, таких как металлы, имеют высокую растворимость в растворителях. Это связано с тем, что металлы имеют большое количество свободных электронов, которые могут легко двигаться по сети атомов металла и взаимодействовать с растворителем.
С другой стороны, вещества с малым распределением электронной плотности имеют низкую растворимость. Например, некоторые ионные соединения, у которых электроны сильно связаны с ионами, могут быть слабо растворимыми в неполярных растворителях.
Распределение электронной плотности также влияет на полярность вещества и растворителя. Если растворитель и вещество обладают схожими свойствами и электронные облака совмещаются в пространстве, распределение электронной плотности будет способствовать более легкому смешиванию вещества с растворителем и повышению его растворимости.
Таким образом, распределение электронной плотности влияет на межмолекулярное взаимодействие вещества и растворителя, что определяет его растворимость.
Растворимость ионного соединения
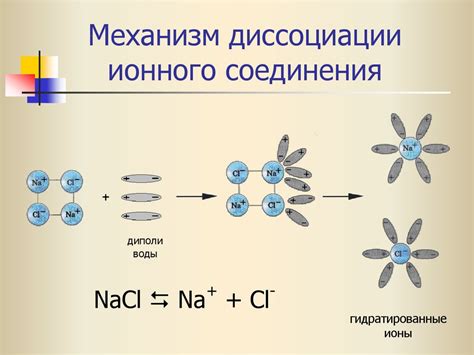
Растворимость ионного соединения зависит от ряда факторов:
1. Тип ионов. Ионные соединения состоят из положительно и отрицательно заряженных ионов. Растворимость зависит от величины заряда иона и его радиуса. Соединения с ионами маленького размера и большим зарядом имеют обычно меньшую растворимость, так как их ионы сильнее притягиваются к себе и сложнее переходят в раствор.
2. Растворимость ионов. Некоторые ионы лучше растворяются в воде, другие – в органических растворителях. Например, ионы аммония (NH4+) обладают большей растворимостью в воде, а ионы хлорида (Cl-) – в метаноле.
3. Температура. Влияние температуры на растворимость ионного соединения зависит от специфики соединения. Некоторые ионные соединения распадаются на ионы при нагревании, что увеличивает их растворимость, например, NaCl. Другие, например, AgCl, имеют обратную зависимость – при нагревании растворимость снижается.
4. Концентрация раствора. При достижении определенной концентрации раствора, ионное соединение может перейти в нерастворимую форму, образовав осадок.
Изучение растворимости ионных соединений позволяет предсказывать их поведение в различных условиях и оптимально использовать их свойства в различных отраслях науки и техники.
Поляризующая способность растворителя
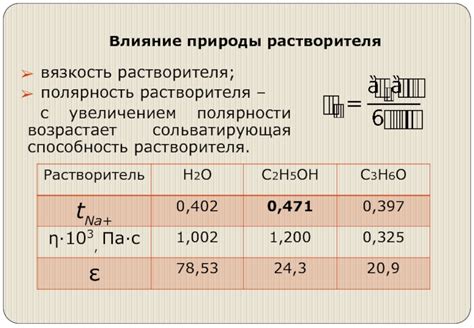
Полярность растворителя зависит от его химической структуры и наличия полярных связей или дипольных моментов. Растворители с большим количеством полярных связей обычно обладают высокой поляризующей способностью.
Влияние поляризующей способности растворителя на растворимость веществ заключается в том, что полярные вещества лучше растворяются в полярных растворителях, а неполярные вещества растворяются лучше в неполярных растворителях. Это связано с тем, что полярные частицы вещества взаимодействуют с полярными частицами растворителя, образуя более сильные межмолекулярные силы.
Однако надо отметить, что на растворимость вещества влияют не только его полярность и поляризующая способность растворителя, но и ряд других факторов, таких как температура, давление и концентрация раствора.
Величина растворимости
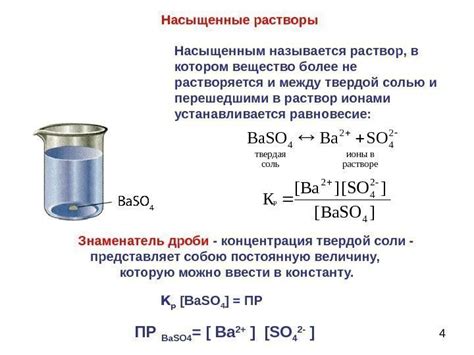
Зависимость растворимости вещества от концентрации и температуры может быть представлена в виде графика или таблицы. Обычно растворимость веществ увеличивается с увеличением концентрации растворителя или с увеличением температуры.
Для веществ, которые существуют в нескольких кристаллических формах (полиморфные вещества), растворимость может различаться в зависимости от кристаллической структуры и условий растворения. Например, некоторые полиморфные формы лекарственных веществ имеют разную растворимость и, следовательно, разную биодоступность.
Растворимость вещества также может быть влияна эффектом других добавок или растворителей. Например, введение специальных добавок (солей, комплексообразователей и т. д.) может увеличить растворимость некоторых веществ.
| Вещество | Растворимость (г/100 г) | Температура (°C) |
|---|---|---|
| Натрия хлорид | 35,9 | 25 |
| Калия нитрат | 31,6 | 25 |
| Хлорида кальция | 65,7 | 25 |
Структура и масса молекулы
Структура молекулы вещества может быть простой или сложной. Простые молекулы, такие как молекулы газов и жидкостей, имеют простую структуру и содержат только несколько атомов. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода. Сложные молекулы, такие как полимеры, белки и нуклеиновые кислоты, содержат большое количество атомов.
Масса молекулы вещества также играет важную роль в его растворимости. Молекулы со значительной массой обычно имеют большую вязкость и могут быть менее растворимыми в растворителе. Это связано с тем, что более массивные молекулы могут образовывать более сильные межмолекулярные силы, которые затрудняют их разделение и перемещение в растворе.
Однако структура и масса молекулы не являются единственными факторами, влияющими на растворимость вещества. Другие факторы, такие как температура, давление и химические свойства раствора и растворимого вещества, также могут оказывать влияние на этот процесс.
Окружающая среда

Окружающая среда может оказывать значительное влияние на растворимость веществ в растворителях. Во-первых, физические условия окружающей среды, такие как температура и давление, могут влиять на процесс растворения. Высокие температуры, например, могут увеличить скорость растворения вещества. Повышенное давление также может способствовать растворению вещества. В то же время, экстремальные условия, такие как очень низкие температуры или высокие давления, могут затруднить растворение.
Кроме того, состав самой окружающей среды может влиять на растворимость вещества. Например, наличие других растворенных веществ или примесей может оказывать влияние на растворимость. Иногда наличие определенных ионов или молекул может способствовать растворению, а иногда - наоборот, затруднить его.
Другой важный фактор окружающей среды - рН. Кислая или щелочная окружающая среда может влиять на растворимость вещества. Некоторые вещества могут растворяться лучше в щелочных условиях, а некоторые - в кислых.
Окружающая среда также может включать в себя различные растворители, которые могут воздействовать на растворимость вещества. Некоторые растворители могут эффективно растворять определенные вещества, в то время как другие не способны к этому. Полярность растворителя и вещества, которое необходимо растворить, также может играть роль в процессе растворения.
В целом, окружающая среда имеет большое значение при растворении веществ в растворителях. Физические и химические условия, состав окружающей среды и тип растворителя могут оказывать сильное влияние на растворимость вещества.
Связь между частицами вещества и растворителя
Растворимость вещества в растворителе зависит от взаимодействия и связей между частицами вещества и растворителя. Частицы вещества могут быть ионными, молекулярными или атомными.
В случае ионных веществ, растворимость определяется силой электростатического притяжения или отталкивания между ионами вещества и ионами растворителя. Если взаимодействия с ионами растворителя сильнее, чем взаимодействия между ионами вещества, то растворение происходит. Например, в случае солей, когда ионы вещества окружаются ионами растворителя и образуют гидратированные ионы.
Для молекулярных веществ важна поларность молекул. Если молекулярные вещества имеют полюса и образуют диполь-дипольные взаимодействия с молекулами растворителя с схожей полюсностью, то растворение происходит. Например, в случае алкоголей, которые имеют полюсные группы и хорошо растворятся в воде.
Атомные вещества могут растворяться в растворителе благодаря слабым дисперсионным силам притяжения или размерам ионов. Например, инертные газы могут растворяться в жидком аммиаке благодаря слабым дисперсионным силам притяжения между атомами.



