Закон сохранения массы является одной из основных фундаментальных принципов химических реакций. Согласно этому закону, все химические реакции происходят с сохранением общей массы вещества. Это означает, что сумма массы реагентов в химической реакции равна сумме массы продуктов реакции.
Принцип сохранения массы был установлен в процессе научных исследований и экспериментов, проведенных французским химиком Антуаном Лавуазье в конце XVIII века. Этот принцип является одним из основополагающих в химии и имеет важное значение для понимания молекулярной структуры вещества и химических реакций в целом.
Для доказательства закона сохранения массы химики используют методы взвешивания реагентов и продуктов реакции. При проведении эксперимента масса реагентов взвешивается перед началом реакции, а после ее завершения масса продуктов сравнивается с исходной. Если закон сохранения массы соблюдается, то масса реагентов будет равна массе продуктов.
Что такое закон сохранения массы в химии?

Примером применения закона сохранения массы может служить реакция сжигания углеродного топлива, такого как уголь или нефть. Когда углеродное топливо сгорает, происходит реакция с кислородом из воздуха, и в результате образуется диоксид углерода и вода. Масса диоксида углерода и воды, образующихся в результате сгорания, будет равна массе углеродного топлива и кислорода, которые были изначально задействованы в реакции. Это еще раз подтверждает закон сохранения массы в химии.
Кем был формулирован закон сохранения массы?

Основные принципы закона сохранения массы

Этот закон основывается на предположении, что во время химической реакции ни один атом не может появиться или исчезнуть. Вместо этого, атомы переупорядочиваются, образуя новые соединения.
В химии существуют два основных принципа закона сохранения массы:
- Массовое балансирование - все атомы, принадлежащие реагентам, должны быть учтены в продуктах. Массы реагентов и продуктов должны быть сбалансированы, то есть равными друг другу.
- Молярное балансирование - все элементы, присутствующие в реакции, должны быть учтены. Количество молекул реагентов и продуктов должно быть сбалансировано по количеству атомов каждого элемента.
Примеры применения закона сохранения массы можно найти в множестве реакций. Например, при сжигании углеводородов в атмосфере, молекулы углерода и водорода переупорядочиваются, образуя углекислый газ и воду. Общая масса углерода и водорода в реагентах будет равна общей массе углекислого газа и воды в продуктах.
Закон сохранения массы является фундаментальным принципом химии и является основой для понимания и предсказания результата химических реакций. Соблюдение закона сохранения массы позволяет проводить точные расчеты и лежит в основе многих химических процессов и технологий.
Примеры нарушения закона сохранения массы

Вот некоторые примеры нарушения закона сохранения массы:
- Реакции, сопровождающиеся выделением или поглощением газа. Например, при распаде аммиака (NH3) на азот (N2) и водород (H2), масса газовых продуктов будет больше, чем масса исходного аммиака.
- Реакции, сопровождающиеся образованием или разложением твердых веществ. Например, при нагреве гидратированной меди(II)сульфата (CuSO4·5H2O), масса продуктов будет меньше, чем масса исходного гидрата.
- Реакции, сопровождающиеся образованием или разложением воды. Например, при реакции между алюминием (Al) и серной кислотой (H2SO4) образуется алюминий сульфат (Al2(SO4)3) и вода (H2O), при этом масса продуктов будет больше, чем масса исходных реагентов.
- Ядерные реакции, такие как деление ядер или синтез новых ядерных частиц. В ядерных реакциях масса может быть конвертирована в энергию в соответствии с уравнением Эйнштейна E = mc^2, где E - энергия, m - масса, c - скорость света.
Несмотря на эти примеры нарушения, закон сохранения массы остается одним из основных принципов химии и широко используется для анализа химических реакций и рассчета количества веществ, участвующих в реакции.
Процессы, подтверждающие закон сохранения массы
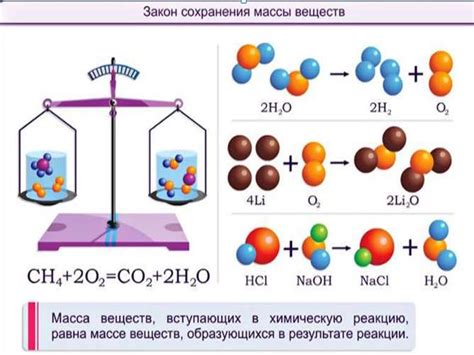
Процессы, которые подтверждают закон сохранения массы, включают:
- Сгорание вещества. При сгорании древесины или углеводородов в кислороде, образуются диоксид углерода и вода. Общая масса древесины и кислорода должна быть равна общей массе диоксида углерода и воды, которые образуются.
- Электролиз. В ходе электролиза воды, молекула воды разлагается на молекулы водорода и кислорода. Общая масса воды должна быть равна суммарной массе водорода и кислорода.
- Пресных водоемов. В природе, пресные водоемы соленые передают минералы из почвы и других источников. Однако, общая масса минералов в воде остается неизменной.
- Метаболизм в организмах. Процессы питания и обмена веществ в организмах также подчиняются закону сохранения массы. Все вещества, поступающие в организм, должны быть использованы или удалены, и общая масса остается постоянной.
Закон сохранения массы является фундаментальным для понимания и изучения химических реакций. Он описывает, как вещества превращаются в другие вещества, сохраняя свою общую массу. Этот закон оказывает важное влияние на различные области науки и технологии, такие как промышленность, медицина и пищевая промышленность.
Важность закона сохранения массы в химических реакциях

То есть, масса реагентов, которые превращаются в продукты реакции, всегда равна массе этих продуктов. Это означает, что в результате химической реакции не создается новая масса и не исчезает старая. Масса веществ, участвующих в реакции, просто перераспределяется.
Закон сохранения массы в химических реакциях имеет большое значение для многих областей химии и является важным инструментом в исследовании и понимании химических процессов.
Соблюдение закона сохранения массы позволяет установить точное соотношение между массой реагентов и продуктов реакции, что является основой для вычисления стехиометрического соотношения между веществами в химической реакции. Это помогает в определении оптимальных условий реакции и разработке новых химических процессов.
Кроме того, закон сохранения массы позволяет проводить анализ и экспериментальные измерения в химии. Если в результате химической реакции масса реагентов и продуктов не совпадает, это может указывать на нарушение закона сохранения массы или на ошибку при проведении эксперимента.
Важно отметить, что закон сохранения массы не отменяется даже при изменении физических или химических свойств веществ в процессе реакции.
Таким образом, понимание и соблюдение закона сохранения массы являются необходимыми для достижения точных результатов в химических исследованиях и установления причинно-следственных связей между веществами в химических реакциях. Этот закон является одним из фундаментальных принципов химии и важным инструментом для развития химической науки и технологий.



