Вода является одним из самых распространенных веществ на Земле и играет ключевую роль во многих химических процессах. Она состоит из двух атомов водорода и одного атома кислорода, объединенных ковалентной связью. Вода обладает рядом уникальных свойств, одно из которых - ее способность быть реагентом в различных химических реакциях.
Вода может быть и окислителем, и восстановителем, в зависимости от химического соединения, с которым она взаимодействует. Часто вода реагирует как нейтральное вещество, но в определенных условиях она может принимать участие в окислительно-восстановительных реакциях.
Одной из основных химических реакций, в которых участвует вода, является гидролиз. Гидролиз - это процесс разложения сложных химических соединений с помощью воды. В ходе гидролиза молекулы воды разделяются на ионы: H+ (катион) и OH- (анион), которые взаимодействуют с молекулами других веществ. Гидролиз часто приводит к образованию новых соединений и изменению свойств реагентов.
Кроме того, вода может быть и мощным растворителем. Благодаря своей полярности, вода способна растворять как поларные, так и некоторые неполярные соединения. В процессе растворения вещества в воде, происходят химические реакции между молекулами вещества и молекулами воды. Вода образует гидратные оболочки вокруг растворенных ионов и молекул соединения, что способствует его распаду или сопряжению в химических реакциях.
Химические свойства воды

- Диссоциация воды. В воде происходит диссоциация, то есть ее молекулы распадаются на ионы - положительные ион водорода (H+) и отрицательные ионы гидроксила (OH-), т.е. H2O → H+ + OH-. Эта реакция обуславливает способность воды выступать в роли электролита и образовывать кислотно-щелочной баланс.
- Нейтрализационные реакции. Вода может служить средой для нейтрализационных реакций, в которых кислота и основание образуют соль и воду. Например, реакция между соляной кислотой (HCl) и гидроксидом натрия (NaOH) приводит к образованию хлорида натрия (NaCl) и воды (HCl + NaOH → NaCl + H2O).
- Окислительно-восстановительные реакции. Вода может участвовать в окислительно-восстановительных реакциях как окислитель (активный кислород), так и восстановитель. Например, вода может быть окислителем при взаимодействии с металлами, в результате которого образуется водород.
- Гидратация. Вода может гидратировать растворенные вещества, то есть образовывать с ними химически стабильные соединения. Например, при растворении кальция в воде происходит образование гидроксида кальция (Ca(OH)2), которая существует в виде гидрата.
- Электролиз воды. Под действием электрического тока вода может распадаться на водород и кислород. Это реакция, происходящая с образованием водорода у отрицательного электрода и кислорода у положительного электрода (2H2O → 2H2 + O2).
Химические свойства воды играют важную роль не только в химических процессах, но и в жизни организмов. Они определяют ее существование и функции в природе.
Реакция воды с щелочью
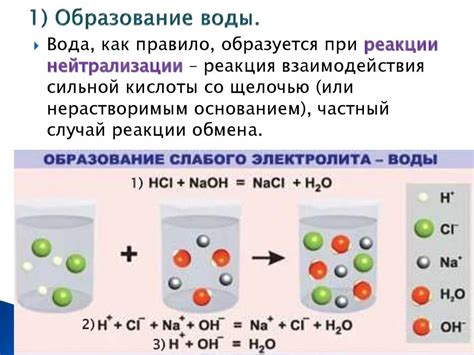
Вода взаимодействует с щелочными веществами, такими как гидроксиды натрия (NaOH) или калия (KOH), образуя гидроксид и основу. Эта реакция известна как гидролиз.
Гидролиз воды с щелочью происходит в два этапа:
1. Диссоциация. Щелочь диссоциирует в водном растворе, высвобождая ионы гидроксида (OH-) и катионы металла (Na+ или K+). Например, в случае гидроксида натрия, реакция выглядит следующим образом:
NaOH → Na+ + OH-
2. Гидролиз. Ионы гидроксида (OH-) реагируют с молекулами воды (H2O), образуя гидроксид-ионы (OH-) и ионы водорода (H+). Эти реакции могут быть описаны следующим образом:
OH- + H2O → HO- + H2O
H2O + H2O → H3O+ + OH-
Таким образом, в результате гидролиза вода превращается в ионы гидроксида (OH-) и ионы водорода (H+), что делает раствор щелочи щелочным.
Реакция воды с щелочью играет важную роль во многих химических процессах и применяется в различных промышленных отраслях, включая производство мыла, стекла, и очистки воды.
Взаимодействие воды с кислотами

Вода проявляет реакцию со многими кислотами, образуя соли и кислотный остаток. Кислоты взаимодействуют с водой путем передачи протона (H+), и такие реакции называются протолитическими реакциями.
Когда кислота растворяется в воде, она диссоциирует на ионы водорода (H+) и анионы, которые составляют кислотный остаток. На примере соляной кислоты (HCl), реакция протекает следующим образом:
HCl + H2O → H3O+ + Cl-
Образовавшийся ион водорода (H3O+) называется гидроксонием. Именно он придает раствору кислоты кислотные свойства. Кислотные растворы, содержащие большое количество гидроксониевых ионов, обладают кислыми свойствами и могут высоко реагировать при взаимодействии с другими веществами.
Вода также может проявлять амфотерные свойства, т.е. она может взаимодействовать как с кислотами, так и с основаниями. При этом, она может принимать на себя протон из кислоты или отдавать его основанию, в зависимости от условий реакции.
Реакция воды с металлами

Вода действует на металл путем окисления его атомов. При этом атомы металла отдают электроны и образуют ионы металла. Молекулы воды, в свою очередь, получают эти электроны и превращаются в ионы водорода и гидроксида.
Процесс реакции воды с металлами можно представить уравнением:
Металл + Вода → Гидроксид металла + Водород
Примером такой реакции может служить реакция калия с водой:
2K + 2H2O → 2KOH + H2
Реакция воды с металлами обычно сопровождается выделением пузырьков водорода газа. Гидроксид металла, который образуется в результате реакции, может быть растворимым или нерастворимым в воде в зависимости от конкретного металла.
Реакция воды с металлами имеет практическое значение, так как вода часто используется для охлаждения различных металлических конструкций и оборудования. При этом происходит коррозия металла, что может привести к его разрушению.
Реакция воды с солями

Вода может реагировать со многими солями, образуя растворы, которые могут быть кислотными, щелочными или нейтральными в зависимости от свойств соли.
Когда соль растворяется в воде, происходит разделение на ионы. Вода, в свою очередь, вступает в реакцию с этими ионами, образуя новые вещества.
Реакция воды с кислотными солями приводит к образованию кислотных растворов. Например, хлорид водорода (соляная кислота) реагирует с водой по следующей схеме:
HCl + H₂O → H₃O⁺ + Cl⁻
Как видно, в результате реакции образуется положительный ион гидрония (H₃O⁺), который делает раствор кислотным.
Реакция воды с щелочными солями приводит к образованию щелочных растворов. Например, гидроксид натрия реагирует с водой по следующей схеме:
NaOH + H₂O → Na⁺ + OH⁻ + H₂O
В результате реакции образуются ионы гидроксида (OH⁻), которые делают раствор щелочным.
Реакция воды с нейтральными солями не приводит к изменению pH раствора. Например, хлорид натрия реагирует с водой по следующей схеме:
NaCl + H₂O → Na⁺ + Cl⁻
Реакция не приводит к образованию ионов гидрония (H₃O⁺) или гидроксида (OH⁻), поэтому pH раствора остается нейтральным.
Окислительные свойства воды

Вода обладает не только растворяющими и растворимыми свойствами, но и способностью проявлять окислительные свойства. Окислительные свойства воды выражаются в ее способности выступать в качестве окислителя, то есть получать электроны от других веществ.
Наиболее известной химической реакцией, демонстрирующей окислительные свойства воды, является электролиз. В процессе электролиза воды под действием постоянного электрического тока происходит разложение молекулы воды на кислород и водород. При этом вода действует в качестве окислителя, получая электроны от анода. Образовавшийся кислород выделяется на аноде, а образовавшийся водород выделяется на катоде.
Окислительные свойства воды проявляются и в реакции с некоторыми металлами. Например, вода может окислять металлы, такие как цинк или алюминий, образуя соответствующие металлические оксиды и выделяя водород. Реакция воды с цинком представляется следующим уравнением:
| Вещество | Реакция |
|---|---|
| Цинк (Zn) | Zn + 2H₂O → Zn(OH)₂ + H₂ |
Таким образом, вода в данном случае выступает в качестве окислителя, получая электроны от цинка и образуя водород.
Окислительные свойства воды также проявляются при реакции воды с некоторыми неорганическими соединениями, например, с сульфитами или серосодержащими соединениями. В результате таких реакций вода получает электроны, окисляя указанные соединения и образуя соответствующие окислы. Например, реакция воды с сульфитом натрия может проходить следующим образом:
| Вещество | Реакция |
|---|---|
| Сульфит натрия (Na₂SO₃) | 2Na₂SO₃ + 2H₂O → 2NaHSO₃ + H₂↑ |
Таким образом, вода в данной реакции выступает в качестве окислителя, получая электроны от сульфита натрия и образуя водород.
Окислительные свойства воды играют важную роль в различных химических процессах, а также находят применение в различных областях науки и промышленности.
Реакция воды с органическими веществами

Когда вода реагирует с карбонильными соединениями, такими как альдегиды и кетоны, образуется гемиацетал или гемикарбинал соответственно. Эти реакции играют важную роль во многих биологических процессах.
Вода также может реагировать с ненасыщенными соединениями, такими как алкены и алкины, образуя гидратированные продукты. Эти реакции нередко используются в синтезе органических соединений.
Реакция воды с органическими кислотами приводит к образованию карбонатов или гидроксидов, в зависимости от степени окисления атомов углерода в карбонильной группе. Кислоты с электрофильными функциональными группами могут также реагировать с водой, образуя эстеры и амиды соответственно.
Вода также может реагировать с органическими аминами, образуя соли аммония или амиды. Эти реакции происходят в щелочной среде и могут быть использованы для синтеза различных соединений.
Химические реакции воды в природе

Вода, являющаяся одним из основных природных ресурсов, участвует во множестве химических реакций. Эти реакции происходят как на поверхности Земли, так и под землей, в океанах и реках, и играют важную роль в жизни нашей планеты.
Одной из основных реакций, в которых участвует вода, является гидролиз. Гидролиз - это процесс, при котором вода расщепляется на положительные и отрицательные ионы. В результате гидролиза образуются растворы, имеющие разные химические свойства.
Например, гидролиз солей - это реакция, при которой соль растворяется в воде и образует ионы. Эти ионы могут проявлять кислотные или щелочные свойства, в зависимости от своей природы. Таким образом, гидролиз солей влияет на кислотно-основное равновесие в воде и может оказывать влияние на водный биотоп.
Вода также может реагировать с кислотами и основаниями, образуя соли. Реакция воды с кислотами называется нейтрализацией. При этой реакции вода получает протон от кислоты, что позволяет ей увеличить концентрацию гидроксидных ионов и изменить pH среды. Это является основным механизмом, позволяющим воде поддерживать оптимальный pH для многих организмов.
С другой стороны, реакция воды с основаниями также протекает в природных условиях. Она приводит к образованию солей и протекает по аналогии с нейтрализацией, только в обратном направлении. Кроме того, вода может реагировать с некоторыми минералами, такими как известняк или гипс, и образовывать новые соединения.
Важно отметить, что изменение водного состояния, также известное как фазовые переходы, также являются химическими реакциями. При повышении температуры вода может превратиться в пар, а при понижении - в лед. Эти фазовые переходы являются результатом химических процессов, которые происходят воде в зависимости от температуры и давления.
Таким образом, химические реакции воды играют важную роль в природе. Они влияют на кислотно-основной баланс, способствуют образованию новых соединений и обеспечивают необходимые условия для поддержания жизни на Земле.



