Вещество – это все, что занимает место в пространстве и имеет массу. Все вещества состоят из частиц, которые называются атомами. Атомы слишком маленькие, чтобы с ними можно было работать непосредственно, поэтому они исследуются с помощью различных методов и приборов.
Атомы – это настолько маленькие частицы, что их нельзя увидеть даже самым мощным микроскопом. Однако, благодаря современным научным исследованиям, мы можем представить их структуру. Каждый атом состоит из ядра и электронной оболочки.
Ядро атома содержит нейтронов и протонов. Нейтроны не имеют заряда, а протоны имеют положительный заряд. Оболочка атома в свою очередь состоит из электронов. Электроны имеют отрицательный заряд и образуют вокруг ядра некий электронный «облако».
Атомы различаются по количеству протонов и электронов, что определяет их свойства и взаимодействие. Разные элементы имеют различную структуру атома, что приводит к разнообразию свойств и состояний вещества.
Определение атома

Атомы состоят из трех основных частей: протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, а электроны движутся вокруг ядра по энергетическим уровням.
Протоны имеют положительный электрический заряд, нейтроны не имеют заряда, а электроны имеют отрицательный электрический заряд. Количество протонов в атоме определяет его атомный номер, который также является идентификатором химического элемента в таблице Менделеева.
Атомы могут образовывать связи друг с другом, образуя молекулы. Различные комбинации атомов образуют разные вещества с различными свойствами.
Изучение атомов и их свойств помогает понять основы химии и физики, а также применять их знания в различных областях науки и технологий.
Исторический обзор

Изучение структуры вещества и атомов было важным моментом в развитии науки. Исследователи древности уже задумывались о том, из каких элементов состоят вещества. Древние греки предполагали, что существует определенное количество базовых веществ, которые могут образовывать все остальные вещества. Эту концепцию назвали теорией четырех стихий. Однако, она не была научно обоснована и оставалась гипотезой.
С развитием науки и технологий, ученые стали проводить серьезные эксперименты и исследования. В 19-20 веке, физики и химики начали проводить различные эксперименты, чтобы более полно понять строение и свойства атомов. Особую роль в этом сыграла разработка методов химического анализа и физических методик, которые позволили ученым получить более точные данные о атомах и молекулах.
Одним из важнейших моментов в истории изучения атомов было открытие электрона. В 1897 году Джозеф Джон Томсон установил, что атом состоит из отрицательно заряженных электронов, которые находятся в положительно заряженной оболочке. Эта теория получила широкое признание и стала одной из основных теорий о строении атома.
Строение атома
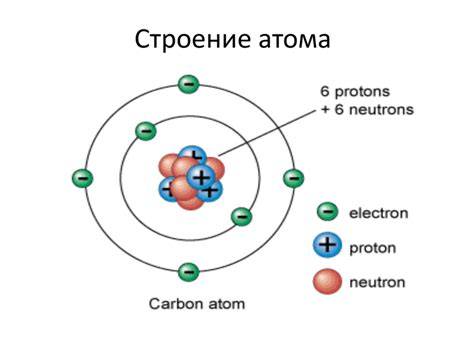
Протон имеет положительный заряд и находится в центре атома, который называется ядром. Нейтрон не имеет заряда и также находится в ядре.
Вокруг ядра движется электрон, который имеет отрицательный заряд. Он находится на определенных энергетических уровнях, которые называются орбитами.
Строение атома можно представить схематически: ядро с протонами и нейтронами, окруженное орбитами с электронами.
Сочетание количества протонов и электронов определяет химические свойства атома и его положение в расположении элементов в таблице Менделеева.
Протоны и нейтроны образуют ядро атома, а электроны находятся на орбитах, создавая электронную оболочку. Протоны и электроны имеют противоположные по знаку заряды, а нейтроны не имеют заряда.
Ядро атома
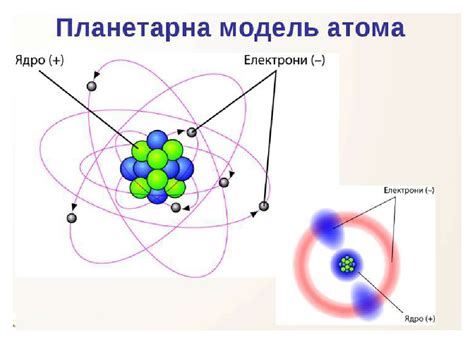
Ядро атома обладает значительной плотностью, так как оно содержит большое количество частиц, сосредоточенных в относительно маленьком объеме. Для сравнения, размер ядра атома составляет около 1/10000 размера всего атома. Это делает ядро атома очень плотным и стабильным.
Протоны и нейтроны в ядре атома образуют ядро, которое обычно обозначается символом Z (атомный номер). Атомный номер определяет количество протонов в ядре. Нейтроны не вмешиваются в процессы химических реакций и служат для поддержания стабильности ядра.
Ядро атома обладает положительным зарядом, так как в нем находятся протоны, обладающие положительным электрическим зарядом. Заряд ядра компенсируется электронами, которые движутся вокруг ядра и образуют электронную оболочку атома.
Структура и свойства ядра атома являются основой для понимания химических реакций и физических процессов, происходящих в микромире.
Электроны в атоме
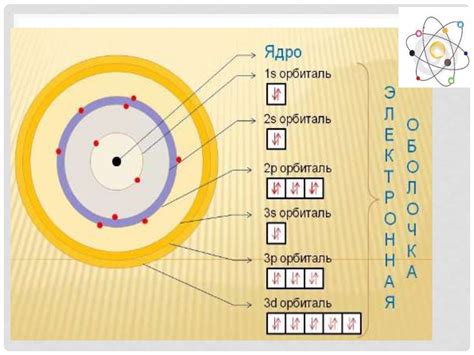
Каждый атом имеет определенное количество электронов. Это количество определяет химические свойства атома и его возможность образовывать химические связи с другими атомами. Электроны распределены в различных энергетических уровнях, также известных как электронные оболочки или орбитали.
Первая электронная оболочка может содержать максимум 2 электрона, вторая оболочка - до 8 электронов, а третья оболочка - также до 8 электронов. Когда атом имеет полностью заполненные электронные оболочки, он становится стабильным и не склонным к образованию химических связей.
Электроны находятся в постоянном движении вокруг ядра, создавая структуру атома. Их положение и скорость определены квантовой механикой. По мере приближения к ядру, энергетические уровни электронов становятся более компактными и все сложнее описать их поведение.
Электроны играют важную роль в химических реакциях, так как их перемещение между атомами приводит к образованию химических связей. Понимание структуры электронов в атоме позволяет увидеть, как атомы соединяются, образуя молекулы и кристаллы, и как они взаимодействуют с другими веществами.
Виды и свойства атомов
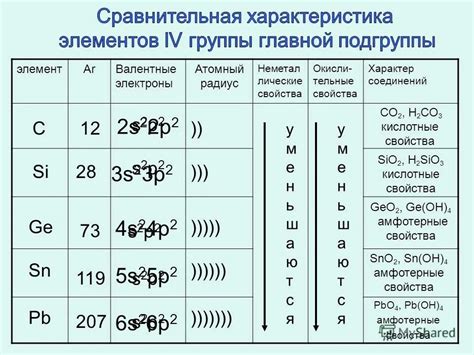
Химические элементы. Атомы могут быть различных видов, называемых химическими элементами. На данный момент в таблице химических элементов их более 100, каждый из которых представлен уникальным атомом. Некоторые из этих элементов являются основными строительными блоками вещества, такими как углерод, кислород и железо.
Строение атомов. Атомы состоят из трех основных частиц: протонов, нейтронов и электронов. Протоны - это положительно заряженные частицы, нейтроны не имеют заряда, а электроны - отрицательно заряженные частицы, которые обращаются вокруг ядра атома. Число протонов определяет химический элемент, а число нейтронов может варьироваться и вызывать образование изотопов.
Размеры и масса атомов. Атомы очень малы и их размеры измеряются в единицах, таких как ангстремы (1 ангстрем = 10^-10 метра). Например, атом углерода имеет размер около 0,77 ангстрема. Масса атомов измеряется в атомных единицах, где углеродный атом имеет массу приблизительно равную 12 атому.
Электронные оболочки. Атомы имеют электронные оболочки, в которых находятся электроны. Эти оболочки расположены на различных энергетических уровнях, которые называются энергетическими оболочками. Первая энергетическая оболочка ближе всего к ядру и может содержать максимум 2 электрона. Следующие оболочки могут содержать более электронов, но с увеличением энергии.
Химическая активность. Свойства атомов определяют их химическую активность. Атомы стремятся заполнять свои электронные оболочки, чтобы достичь стабильности. Атомы с неполными оболочками, называемыми валентными электронами, могут значительно влиять на реакции и связи с другими атомами. Химическая активность атомов может определять их способность к образованию соединений и взаимодействию с другими веществами.
Химические элементы
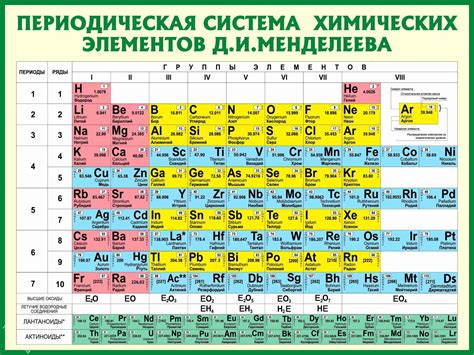
Каждый химический элемент обозначается уникальным символом, состоящим из одной или двух букв. Некоторые символы происходят от латинских названий элементов, например, H (водород), C (углерод), Fe (железо), а некоторые имеют происхождение из немецкого или русского языка, например, Au (золото), Ag (серебро).
Химические элементы классифицируются в таблице Менделеева, которая состоит из периодов и групп. Периоды представляют собой горизонтальные ряды, в которых элементы располагаются в порядке возрастания атомного номера. Группы - это вертикальные столбцы, в которых элементы размещаются по сходству химических свойств.
Химические элементы играют важную роль в различных областях науки и техники. Они являются строительными блоками для создания соединений и материалов. Каждый химический элемент имеет свои уникальные свойства, такие как электроотрицательность, радиус атома, плотность, температура плавления и т. д.
Атомные числа и массы

Помимо атомных чисел, атомы также имеют атомные массы. Атомная масса определяет массу атома и измеряется в атомных единицах массы (аму). Атомная масса атома складывается из массы протонов и нейтронов в его ядре.
Атомное число и атомная масса обычно обозначаются символом элемента, который представляет собой уникальную буквенную аббревиатуру. Например, атомный номер водорода – 1, а атомная масса – около 1 аму. Атомный номер кислорода – 8, а атомная масса – около 16 аму.
Атомные числа и массы используются для определения химических свойств и поведения различных элементов. Путем комбинирования атомов разных элементов образуются молекулы, которые обладают уникальными свойствами и составляют основу химических соединений и веществ.
Соединения и молекулы
Соединения и молекулы играют важную роль в химии и нашей жизни в целом. Они определяют свойства вещества и его возможные реакции.
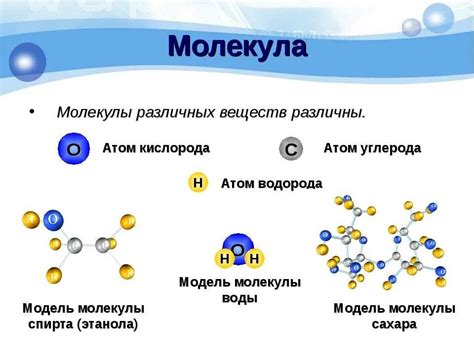
Соединения могут быть бинарными, то есть состоять из двух атомов разных элементов, или многоатомными, когда в их структуре присутствуют более двух разных элементов. Примером бинарного соединения является вода (H2O), состоящая из атома кислорода и двух атомов водорода. Примером многоатомного соединения является глюкоза (C6H12O6), в которой присутствуют атомы углерода, водорода и кислорода.
Молекулы образуются путем химических реакций, в которых происходит перемещение и перераспределение атомов. Некоторые молекулы могут быть очень простыми, состоящими всего из двух атомов, например, молекула кислорода (O2) или азота (N2). Другие молекулы могут состоять из сотен или даже тысяч атомов, образуя сложные структуры, как в случае белков и ДНК.
Важно отметить, что не все соединения и молекулы стабильны. Некоторые могут быть очень реактивными и подвержены распаду или реакции с другими веществами. Это свойство делает их полезными в различных химических процессах, таких как синтез новых соединений или производство энергии.
В итоге, понимание соединений и молекул является основой для изучения химии и позволяет нам лучше понять мир вокруг нас и его составляющие.
Молекулярное строение
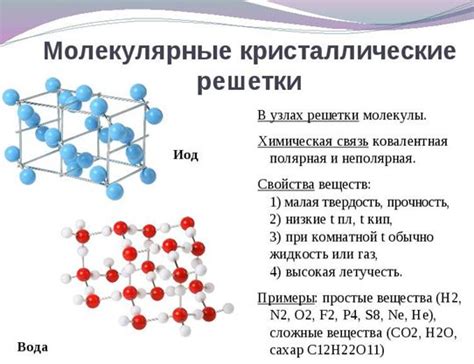
Молекулы состоят из атомов, которые образуют различные связи между собой. В зависимости от типа связи атомы могут образовывать разные структуры. Например, водород и кислород могут образовывать связь между собой, что приводит к образованию молекулы воды (H2O).
Молекулярное строение вещества влияет на его свойства. Например, молекулярное строение может определять физические свойства вещества, такие как температура плавления и кипения, плотность, вязкость и т.д. Также молекулярное строение может определять химические свойства вещества, такие как реакционная способность и стабильность.
Изучение молекулярного строения вещества является важной задачей в химии и других науках. С помощью различных методов и приборов можно определить и описать молекулярное строение вещества. Это позволяет лучше понять свойства и поведение вещества, а также использовать их в различных областях науки и техники.
Химические связи
Ионные связи образуются между атомами, которые обладают разным зарядом. Один атом отдает один или несколько электронов другому атому, образуя положительный и отрицательный ионы. Эти ионы притягиваются друг к другу и образуют ионную связь. Примером вещества, образованного ионными связями, является соль.
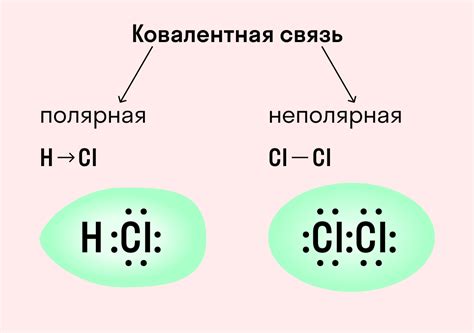
Ковалентные связи образуются, когда два атома делят пару электронов. Такая связь удерживает атомы вместе, образуя молекулу. Вода - пример вещества, с ковалентными связями, где кислородный атом делит свои электроны с двумя атомами водорода.
Металлические связи характерны для металлов и образуются за счет общей электронной оболочки между множеством атомов. Это позволяет металлам образовывать проводящие электрический ток и тепло структуры. Примером металлической связи является металлический драгоценный металл, такой как золото или серебро.
| Тип связи | Описание | Пример |
|---|---|---|
| Ионная связь | Образуется между атомами с разным зарядом. | Соль (NaCl) |
| Ковалентная связь | Образуется, когда два атома делят пару электронов. | Вода (H2O) |
| Металлическая связь | Образуется за счет общей электронной оболочки между металлическими атомами. | Золото (Au) |
Химические связи определяют свойства вещества, его состояние и его реакционную способность. Понимание различных типов связей помогает ученым изучать и изменять вещества в химических реакциях, что открывает новые возможности в различных областях науки и технологии.



