Химия - это наука, изучающая взаимодействие и структуру вещества. В химических реакциях участвуют частицы - атомы, молекулы и ионы. Одной из основных задач химии является определение и измерение количества этих частиц.
В химической науке есть несколько важных величин, которые позволяют определить количество частиц. Одной из них является моль - основная единица измерения количества вещества. Моль определяется как количество вещества, содержащее столько же элементарных частиц, сколько атомов содержит 12 грамм углерода-12. Моль обозначается символом "моль" или "mol".
Количество частиц вещества в молях можно вычислить с использованием таких величин, как молярная масса и концентрация. Молярная масса - это масса одного моля вещества, выраженная в граммах/моль. Масса вещества (в граммах) делится на его молярную массу, и полученное число принимается за количество молей вещества. Концентрация - это количество вещества, содержащееся в единице объема раствора или газа.
Измерение количества частиц в химии является важным для проведения химических расчетов, определения соотношения между реагентами и продуктами, а также для оценки эффективности химических процессов. Понимание методов измерения количества частиц позволяет химикам расширить свои знания о химических реакциях и задать более точные условия их проведения.
Количество частиц в химии: важное понятие
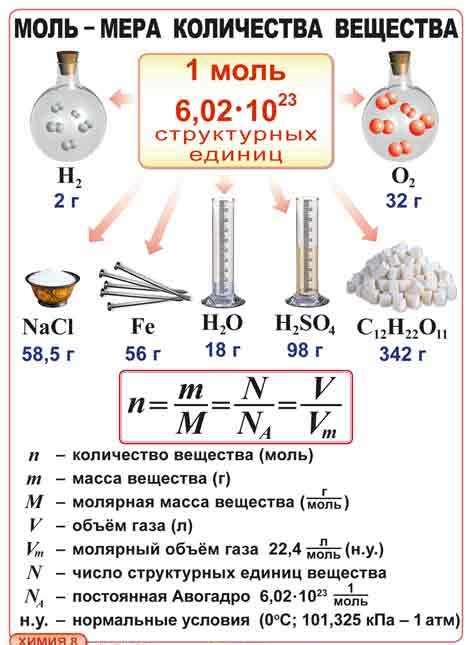
Одна из основных величин, используемых для измерения количества частиц, это моль. Моль представляет собой количество вещества, содержащего столько элементарных единиц, сколько атомов содержится в 12 граммах углерода-12. Это число называется постоянной Авогадро и равно примерно 6,022 × 10^23.
Для небольших количеств частиц часто используются единицы массы, такие как граммы или килограммы. Например, масса одного мола кислорода равна примерно 16 граммам. Таким образом, если имеется 32 грамма кислорода, то это означает, что вещество содержит 2 моля кислорода.
Для измерения количества атомов или молекул вещества иногда используются также понятия "количество элементарных частиц" или "количество молекул", но данные величины чаще всего выражаются в молях.
Количество частиц в химии имеет важное значение при проведении различных реакций и вычислении реакционных соотношений. Кроме того, понимание количества частиц позволяет определить стехиометрию реакции, то есть соотношение между различными веществами, участвующими в химической реакции.
Таким образом, понятие количества частиц в химии является неотъемлемой частью понимания и изучения химических процессов и явлений.
Молярная масса и количество вещества

Молярная масса выражается в граммах на моль (г/моль) и является суммой атомных масс всех атомов, составляющих молекулу вещества. Для расчета молярной массы необходимо знать химическую формулу вещества и атомные массы его составляющих элементов.
Количество вещества, в свою очередь, измеряется в молях (моль). Оно определяет количество молекул или атомов вещества. Количество вещества связано с массой вещества через формулу:
- масса вещества = количество вещества × молярная масса.
Таким образом, для расчета количества вещества необходимо знать массу вещества и его молярную массу.
Удобство использования молярной массы и количества вещества заключается в том, что они позволяют легко переводить между собой массу и количество вещества, что особенно полезно при проведении химических расчетов и прогнозировании результатов химических реакций.
Граммовая молярная масса и количество частиц

В химии для измерения количества частиц существует понятие граммовой молярной массы. Граммовая молярная масса указывает на массу одного моля вещества и измеряется в граммах на моль (г/моль).
Моль является основной единицей измерения количества вещества в химических реакциях. Она определяет количество частиц, равное числу Авогадро – примерно $6.02 \times 10^{23}$ частиц в одном моле.
Граммовая молярная масса вычисляется путем сложения отдельных атомных масс атомов, составляющих молекулу или формулу вещества. Атомная масса измеряется в атомных единицах массы (а.е.м.) или далитонах (Da).
Для примера, рассмотрим воду (H2O). Граммовая молярная масса воды равна приблизительно 18 г/моль. Это означает, что одна моль воды имеет массу 18 г и содержит около $6.02 \times 10^{23}$ молекул.
Граммовая молярная масса позволяет химикам проводить расчеты и определять количество частиц вещества, необходимое для реакции. Она также является важным показателем для определения концентрации вещества в растворе и в других химических процессах.
| Вещество | Формула | Граммовая молярная масса (г/моль) |
|---|---|---|
| Кислород | O2 | 32 |
| Углекислый газ | CO2 | 44 |
| Серная кислота | H2SO4 | 98 |
| Сахароза (сахар) | C12H22O11 | 342.3 |
Таким образом, граммовая молярная масса позволяет химикам проводить точные расчеты и определять необходимое количество частиц вещества для химических реакций и процессов.
Расчет молей и количество атомов

Моль определяется как количество вещества, содержащее столько атомов, молекул или частиц, сколько атомов содержится в 12 граммах углерода-12. Молярная масса, выраженная в г/моль, указывает сколько грамм содержится в одной моли вещества.
Для расчета количества атомов в заданной массе вещества, необходимо использовать следующую формулу:
| Количество атомов | = | Масса вещества (г) | / | Молярная масса (г/моль) | * | 6.022 × 10^23 (число Авогадро) |
Пример:
Для расчета количества атомов в 10 граммах кислорода (O2), необходимо сначала найти молярную массу кислорода. Молярная масса кислорода равна приблизительно 32 г/моль (16 г/моль для одного атома кислорода). Используем формулу:
| Количество атомов | = | 10 (г) | / | 32 (г/моль) | * | 6.022 × 10^23 (число Авогадро) |
Результат будет равен примерно 1.88 × 10^23 атомов кислорода.
Перевод молей в граммы и количество молекул

Один из основных принципов химии состоит в том, что химические реакции происходят между определенным числом молекул, а не произвольным количеством вещества. Для измерения количества частиц, таких как атомы или молекулы, используются молярные единицы.
Моль (моль) - это единица измерения количества вещества в химии. Одна моль вещества содержит Avogadro's number (число Авогадро) частиц, что составляет примерно 6.022 × 10^23. Чтобы преобразовать моли в граммы, используется молярная масса.
Молярная масса - это масса одной моли вещества, выраженная в граммах. Единицей измерения молярной массы является г/моль. Для расчета молярной массы вещества необходимо найти сумму атомных масс всех его составляющих элементов, умноженных на их коэффициенты в формуле вещества.
Чтобы перевести моли в граммы, необходимо умножить количество молей на молярную массу вещества. Формула для этого расчета выглядит следующим образом: масса (г) = количество молей × молярная масса (г/моль).
Аналогично можно перевести количество молекул в граммы, используя моль и молярную массу. Для этого необходимо знать количество молекул, умножить его на мольную постоянную и затем умножить на молярную массу направляемого вещества. Формула для перевода количества молекул в граммы выглядит следующим образом: масса (г) = количество молекул × молярная постоянная × молярная масса (г/моль).
Таким образом, перевод молей в граммы и количество молекул является важной задачей в химии. Правильное использование мольной массы и молярной постоянной позволяет установить соответствующие пропорции для точного измерения и расчета.
Молекулярная масса и количество ионов

Например, молекулярная масса воды (H2O) равна 18,015 а.е.м., так как она состоит из двух атомов водорода (масса атома водорода примерно равна 1,008 а.е.м.) и одного атома кислорода (масса атома кислорода примерно равна 16,00 а.е.м.).
Количество ионов – это число заряженных атомов или групп атомов, образованных при потере или приобретении электронов.
Например, в молекуле хлорида натрия (NaCl) образуется один ион натрия (Na+) и один ион хлора (Cl-). Таким образом, количество ионов в этой молекуле равно 2.
Измерение и анализ молекулярной массы и количества ионов играют важную роль в химии, позволяя определять химические свойства веществ и проводить различные расчеты и эксперименты.
Связь между молярной массой и количеством частиц

Для нахождения количества частиц, используется универсальное газовое уравнение, которое устанавливает пропорциональную связь между количеством частиц, молярной массой и молярным объемом газа. Уравнение записывается следующим образом:
| Универсальное газовое уравнение: |
|---|
| pV = nRT |
где:
- p - давление газа
- V - объем газа
- n - количество частиц (в молях)
- R - универсальная газовая постоянная
- T - температура газа
Молярная масса вещества определяется как отношение массы вещества к количеству вещества в молях. Она измеряется в г/моль и может быть использована для нахождения количества частиц.
Формула для вычисления количества частиц выглядит следующим образом:
| Количество частиц: |
|---|
| n = m/M |
где:
- n - количество частиц (в молях)
- m - масса вещества (в граммах)
- M - молярная масса вещества (в г/моль)
Таким образом, зная молярную массу вещества и его массу, можно определить количество частиц вещества. Эта связь между молярной массой и количеством частиц играет важную роль в химии и используется для расчетов и анализа различных химических процессов.
Применение стехиометрических соотношений

Стехиометрия в химии позволяет определить количество реагентов и продуктов реакции на основе соотношения между ними. С помощью стехиометрических соотношений можно рассчитать, сколько частиц вещества участвует в реакции и сколько образуется в результате.
Для применения стехиометрии необходимо знать химическое уравнение реакции, которое показывает, какие вещества реагируют и какие образуются. В химическом уравнении указывается количество молекул каждого вещества, соотношение между ними и энергетические изменения, происходящие во время реакции.
С помощью стехиометрических соотношений можно определить, сколько молекул или атомов каждого вещества участвует в реакции. Например, если известно количество моль реагента, можно рассчитать, сколько молекул этого реагента участвует в реакции.
Кроме того, стехиометрия позволяет определить соотношение между реагентами и продуктами реакции. Например, если известно количество молекул одного реагента, можно рассчитать, сколько молекул продукта образуется в результате реакции.
Стехиометрические соотношения применяются во многих областях химии, включая органическую, неорганическую и физическую химию. Они играют важную роль в проведении химических реакций, исследовании веществ и производстве химических соединений.
Определение количества частиц через теоретическую выходную массу

Для определения количества частиц через теоретическую выходную массу необходимо знать молярную массу вещества - это масса одного моля вещества, выраженная в граммах. Молярная масса вещества обычно указывается в периодической системе элементов.
Далее необходимо разделить теоретическую выходную массу вещества на его молярную массу. Результат этого деления будет количеством молей вещества.
Количество частиц вещества может быть дополнительно определено, умножив количество молей на постоянную Авогадро. Постоянная Авогадро равна количеству атомов углерода-12 в одном моле вещества и примерно равна 6,022 × 10^23.
Таким образом, определять количество частиц вещества через теоретическую выходную массу можно следующим образом:
Количество частиц = (Теоретическая выходная масса / Молярная масса) × Авогадро
Это позволяет установить связь между массой вещества и количеством его частиц, что важно для проведения различных расчетов и определения реакционных характеристик в химических процессах.
Практическое использование молярной массы и количества частиц
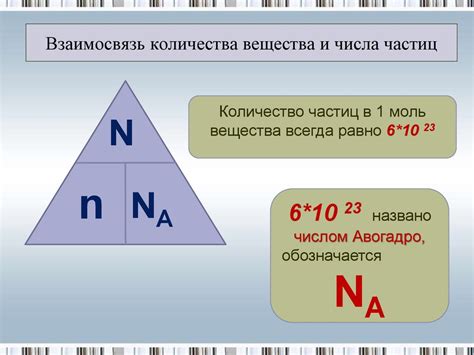
Зная молярную массу вещества, можно определить количество вещества в молях, которое соответствует определенной массе вещества. Это особенно важно при проведении химических реакций, где количество вещества играет ключевую роль.
Кроме того, молярная масса также позволяет связать массу вещества с количеством его частиц. Например, если известно, что молярная масса вещества равна 30 г/моль, то это означает, что в одном моле данного вещества содержится 30 г и 6,022 × 10^23 частиц.
Количество частиц в химии измеряется с помощью такой величины, как количество вещества. Оно обозначается символом "n" и измеряется в молях. Основываясь на определении молярной массы, можно провести простые расчеты для определения количества вещества в системе.
Например, если известна масса вещества (m) и его молярная масса (M), то количество вещества (n) может быть определено по формуле:
n = m / M
Зная количество частиц в системе, можно проводить дальнейшие расчеты, например, для определения количества вещества, участвующего в реакции, или вычисления реакционной стехиометрии.
Таким образом, молярная масса и количество частиц являются важными понятиями в химии, которые находят практическое применение при проведении различных химических расчетов и реакций.



