Плавление - это физический процесс перехода вещества из твердого состояния в жидкое при достижении определенной температуры, которая называется температурой плавления. Во время плавления происходят важные изменения, связанные с энергией и молекулярной структурой вещества.
Когда вещество нагревается до температуры плавления, его молекулы начинают двигаться с большей энергией. Они разрушают кристаллическую структуру твердого вещества и образуют более хаотичное движение жидкости. В этот момент происходит поглощение теплоты, что приводит к замедлению повышения температуры.
Однако, в процессе плавления температура остается постоянной, пока все вещество не перейдет из твердого состояния в жидкое. Это связано с тем, что поглощаемая и теплота разлуки вещества во время плавления идентичны, так как это фазовый переход при постоянной температуре.
Следует отметить, что каждое вещество имеет свою уникальную температуру плавления. Некоторые вещества, такие как железо или лед, имеют высокую температуру плавления, тогда как другие, например, пластмассы или свечи, имеют намного более низкую температуру плавления.
Температура при плавлении
Температура плавления является характеристикой каждого вещества и может варьироваться в широком диапазоне. Например, для воды температура плавления составляет 0 градусов Цельсия, а для алюминия - 660 градусов Цельсия.
Важно отметить, что температура плавления является константой при определенных условиях, таких как атмосферное давление. Изменение давления может влиять на температуру плавления вещества. Например, при повышении давления температура плавления может увеличиваться, а при понижении - уменьшаться.
Температура плавления играет важную роль в промышленности и научных исследованиях. Знание температур плавления различных материалов позволяет контролировать и управлять процессами плавления, а также использовать их в различных технологиях и производствах.
Изменение состояния вещества
Для каждого вещества существует определенная температура, называемая точкой плавления, при которой плавление происходит. На данной температуре молекулы вещества приобретают достаточную энергию для преодоления сил притяжения друг к другу и начинают двигаться свободно, формируя плавное состояние.
| Состояние вещества | Температура плавления |
|---|---|
| Твердое | Выше точки плавления |
| Жидкое | Точка плавления |
| Газообразное | Выше точки кипения |
Плавление – это физический процесс, который не сопровождается изменением химических свойств вещества. При достижении точки плавления вещество сохраняет свою химическую структуру, но его молекулы начинают двигаться с большей свободой, образуя жидкость.
Обратным процессом к плавлению является затвердевание, при котором вещество переходит из жидкого в твердое состояние. В результате затвердевания происходит обратное изменение структуры и взаимного расположения молекул, что сопровождается выделением тепла.
Точка плавления

Точка плавления зависит от различных факторов, включая химический состав вещества и атмосферное давление. На диаграмме состояний вещества точка плавления обозначается горизонтальной линией, соответствующей определенной температуре.
Во время плавления вещество поглощает теплоту, что приводит к повышению его температуры до точки плавления. После достижения этой температуры, вещество начинает расплавляться, и его температура остается постоянной до полного плавления.
Точка плавления является важной характеристикой вещества и может быть использована для его идентификации и разделения от других веществ. Более низкая точка плавления обычно говорит о более слабых межмолекулярных взаимодействиях, а более высокая точка плавления указывает на более сильные взаимодействия.
Однако стоит отметить, что точка плавления может изменяться под влиянием различных факторов, таких как примеси, давление и размер частиц вещества.
Разница в температуре
В процессе плавления твердого вещества его температура остается постоянной, пока не будет полностью расплавлено. Это связано с тем, что в процессе плавления вещество получает избыточную энергию в виде теплоты.
Однако сама процедура плавления сопровождается изменением температуры. Когда твердое вещество нагревается, его молекулы начинают двигаться быстрее, что приводит к увеличению температуры. Когда температура достигает определенного значения, называемого точкой плавления, происходит переход от твердого состояния к жидкому.
Во время плавления температура вещества остается на постоянном уровне, пока полностью не произойдет плавление. Это происходит потому, что расплавление требует энергии, которая уходит на разрушение сил внутреннего взаимодействия между молекулами.
После полного плавления температура может начать снова повышаться, так как она уже необходима для дальнейшего нагревания жидкого состояния.
- Температура повышается в процессе нагревания твердого вещества перед плавлением
- Температура остается постоянной в процессе плавления
- После полного плавления температура может опять повышаться
Энергия плавления
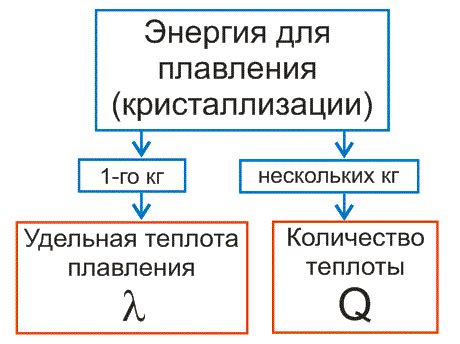
В процессе плавления температура вещества остается постоянной на определенном уровне. Однако, сам процесс плавления требует затрат энергии, известной как энергия плавления.
Энергия плавления представляет собой количество теплоты, которое необходимо передать веществу, чтобы преодолеть силы притяжения между его молекулами и осуществить переход из твердого состояния в жидкое. В момент плавления, энергия тепла, подаваемая к веществу, используется для преодоления этих сил притяжения, причем она не влияет на изменение температуры вещества.
Значение энергии плавления зависит от вещества и его молекулярной структуры. Каждому веществу соответствует определенное количество энергии плавления, измеряемое в джоулях на грамм или калориях на грамм. Например, энергия плавления льда составляет примерно 333,5 джоуля на грамм, тогда как энергия плавления меди составляет около 63,7 джоуля на грамм.
Внешней энергии, требующейся для преодоления сил притяжения и осуществления плавления, соответствует падение температуры вещества. Поэтому, когда твердое вещество находится в процессе плавления, его температура остается на стабильном уровне, пока энергия плавления не будет полностью передана веществу.
Процесс плавления

Во время плавления происходит преобразование регулярной кристаллической решетки твердого вещества в неупорядоченную жидкую структуру. Для этого необходимо преодолеть силы взаимодействия между частицами вещества, что достигается увеличением их энергии движения.
Критическая температура плавления определяет точку, при которой вещество достигает жидкого состояния. Для каждого вещества она различна и является индивидуальной характеристикой.
Процесс плавления сопровождается поглощением тепла, называемого теплотой плавления. Эта энергия используется для преодоления взаимодействий между частицами и разрушения кристаллической структуры.
Однако следует отметить, что температура во время плавления остается постоянной, пока весь материал не превратится в жидкость. Это связано с тем, что в процессе плавления энергия теплоты используется только на преодоление сил взаимодействия частиц, а не на повышение их температуры.
Кроме того, вещества могут иметь различные интервалы температур плавления в зависимости от атмосферного давления. Например, вещества, имеющие низкую температуру плавления при нормальных условиях, могут оставаться в твердом состоянии или переходить в газообразное при пониженном давлении.
| Вещество | Температура плавления (°C) |
|---|---|
| Сера | 115.2 |
| Свинец | 327.4 |
| Алюминий | 660 |
| Железо | 1538 |
Таблица представляет несколько примеров веществ с указанием их температуры плавления при нормальном атмосферном давлении.
Молекулярные связи
При плавлении вещества молекулярные связи между его частицами разрываются, что приводит к изменению физических свойств вещества, включая температуру.
Молекулярные связи играют важную роль в процессе плавления. Вещество с прочными молекулярными связями требует больше энергии, чтобы разорвать эти связи и перейти в состояние плавления. Поэтому для таких веществ требуется высокая температура, чтобы начать плавиться.
Вещество с более слабыми молекулярными связями, напротив, может плавиться при более низкой температуре, так как меньше энергии требуется для разрыва связей между его частицами.
Молекулярные связи могут быть различной природы. В устойчивом кристаллическом состоянии вещества молекулы образуют регулярную кристаллическую решетку, в которой каждая молекула имеет определенное положение и ориентацию. В процессе плавления, молекулы разрушают эту решетку и приобретают возможность свободного перемещения.
Молекулярные связи также влияют на физические свойства плавящихся веществ, такие как вязкость и поверхностное натяжение. При плавлении, молекулы вещества становятся более подвижными, что приводит к снижению вязкости и поверхностного натяжения.
Изучение молекулярных связей в процессе плавления помогает нам понять, как изменяются физические свойства вещества под влиянием изменения температуры и почему некоторые вещества плавятся при более низкой температуре, чем другие.
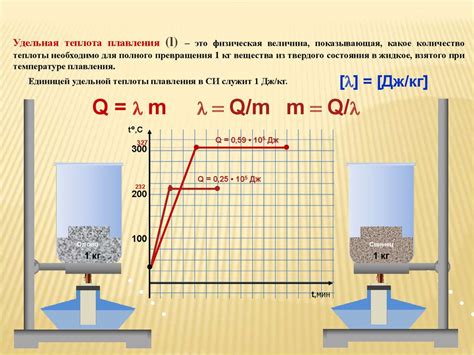
Теплота плавления
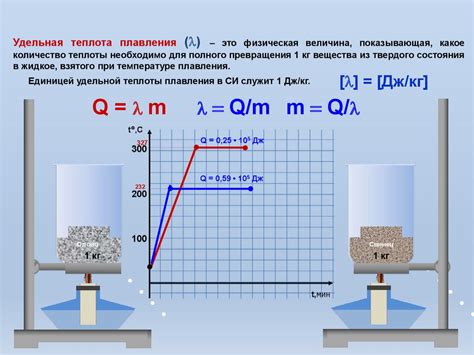
Когда вещество нагревается до температуры плавления, частицы начинают двигаться быстрее, преодолевая притяжение между собой. В этот момент энергия, полученная от теплоты, используется для разрушения упорядоченной структуры твердого вещества и разделения его молекул. Это приводит к образованию жидкости.
Теплота плавления обычно выражается в джоулях на грамм или калориях на грамм и может быть вычислена с использованием уравнения:
Q = m * ΔH
где Q - количество теплоты, m - масса вещества и ΔH - теплота плавления.
Знание значения теплоты плавления позволяет предсказывать, при какой температуре вещество будет плавиться или затвердевать, а также использовать эту информацию в различных технических и промышленных процессах.
Фазовые переходы
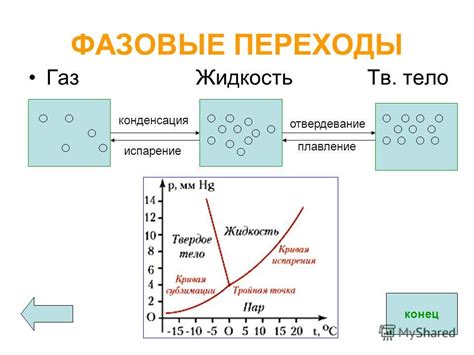
В процессе плавления твердого вещества происходит фазовый переход, когда температура достигает определенного значения, называемого температурой плавления. При этом твердое вещество превращается в жидкость.
Фазовые переходы могут быть обратимыми или необратимыми. Обратимый фазовый переход происходит при плавлении, когда твердое вещество превращается в жидкость, а при охлаждении жидкость снова превращается в твердое состояние. Необратимый фазовый переход происходит при кипении, когда жидкость превращается в газ и не может вернуться в жидкое состояние путем охлаждения.
Температура плавления может быть разной для разных веществ и зависит от их химического состава и структуры. Например, температура плавления воды составляет 0 градусов Цельсия, а температура плавления свинца составляет 327,5 градусов Цельсия.
Зависимость от вещества

Например, у металлов и сплавов температура плавления может быть достаточно высокой, так как межатомные связи в них являются сильными. В то же время, у молекулярных веществ сравнительно низкой молекулярной массой межмолекулярные взаимодействия более слабые, что приводит к более низким температурам плавления.
Для многих элементов и соединений существует таблица с указанием их температур плавления. Например, для воды температура плавления равна 0 градусам Цельсия (при атмосферном давлении). Для свинца это значение составляет 327 градусов Цельсия.
| Вещество | Температура плавления (°C) |
|---|---|
| Вода | 0 |
| Сера | 115 |
| Свинец | 327 |
| Железо | 1535 |
Таблица позволяет сравнивать температуры плавления различных веществ и выявлять их разницу. Важно отметить, что температура плавления может изменяться при изменении внешних условий, таких как давление и наличие примесей. Таким образом, для точного определения температуры плавления необходимо учитывать все факторы, которые могут повлиять на этот процесс.



