Свойства веществ являются одним из ключевых понятий в химии. Они помогают описывать и классифицировать вещества, а также предсказывать и объяснять их поведение и реактивность. Знание свойств веществ позволяет ученым и инженерам создавать новые материалы, разрабатывать лекарства, улучшать производственные процессы и многое другое.
Свойства веществ можно разделить на две основные категории: физические и химические. Физические свойства вещества описывают его состояние (твердое, жидкое или газообразное), цвет, запах, плотность, теплоемкость и т. д. Они могут быть измерены или наблюдены без изменения химического состава вещества.
Химические свойства вещества, с другой стороны, описывают его способность проявлять химические реакции и взаимодействовать с другими веществами. Они могут включать такие свойства, как окислительная или восстановительная активность, кислотность или щелочность, стойкость к коррозии и т. д. Химические свойства вещества могут быть измерены только путем проведения химических экспериментов.
Свойства веществ в химии: основные определения
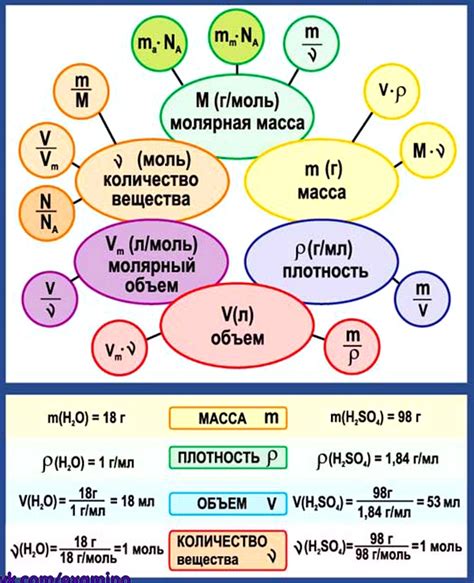
Существует несколько типов свойств веществ в химии:
Физические свойства – это свойства, которые можно изменять без изменения химического состава вещества. Например, плотность, температура плавления, цвет и прозрачность.
Химические свойства – это свойства, которые связаны с возможностью вещества претерпевать химические реакции и образование новых веществ. Например, способность гореть, окисляться или взаимодействовать с кислотой или щелочью.
Физико-химические свойства – это свойства, которые являются результатом совместного влияния физических и химических процессов вещества. Например, растворимость, кислотность или щелочность.
Органические свойства – это свойства, характерные только для органических веществ, т.е. веществ, содержащих углерод. Например, способность образовывать ковалентные связи или претерпевать органические реакции.
Неорганические свойства – это свойства, общие для неорганических веществ, то есть веществ, не содержащих углерод. Например, способность образовывать ионы или взаимодействовать с другими веществами.
Изучение свойств веществ является важной задачей в химии, так как позволяет определить и предсказать, какие процессы могут происходить с веществами и как они будут влиять на окружающую среду и нас самих.
Общая характеристика свойств веществ
| Физические свойства | Химические свойства | Общие свойства |
|---|---|---|
| Физические свойства веществ описывают их физическое состояние (твердое, жидкое или газообразное), плотность, температуру плавления и кипения, электрическую проводимость и другие физические характеристики. | Химические свойства веществ определяют их способность взаимодействовать с другими веществами и претерпевать химические изменения. Они включают реакционную способность, кислотность или щелочность, окислительные или восстановительные свойства и другие. | Общие свойства веществ представляют собой характеристики, которые присущи большинству веществ. Это масса, объем, плотность, их способность переходить из одного состояния в другое (фазовые переходы), теплоемкость и другие. |
Изучение свойств веществ в химии позволяет понять и объяснить их свойства и поведение, а также применять их в практических целях, например, при создании новых материалов или разработке лекарственных препаратов.
Физические свойства веществ: определение и примеры
Примеры физических свойств веществ:
- Температура плавления и кипения: это температуры, при которых вещество переходит из твердого состояния в жидкое и из жидкого в газообразное соответственно. Например, температура плавления воды - 0°C, температура кипения - 100°C.
- Плотность: это мера массы вещества в единице объема. Например, плотность железа - 7,87 г/см³, плотность воды - 1 г/см³.
- Растворимость: это способность вещества растворяться в другом веществе. Например, соль хорошо растворяется в воде, а не растворяется в жире.
- Индекс преломления: это способность вещества изменять направление светового луча при прохождении через него. Например, стекло имеет высокий индекс преломления, а воздух - низкий.
- Теплоемкость: это количество теплоты, необходимое для нагрева вещества на определенную температуру. Например, у разных веществ разная теплоемкость.
Физические свойства веществ являются важными для изучения и понимания их поведения при различных условиях и процессах. Они помогают определить, как вещество будет реагировать с другими веществами и какие физические изменения оно может претерпеть.
Химические свойства веществ: основные черты и примеры
Вот несколько основных химических свойств веществ:
1. Воспламеняемость - способность вещества гореть при взаимодействии с кислородом. Примеры: бумага, бензин.
2. Окислительность - способность вещества передавать кислород или получать электроны в химической реакции. Примеры: кислород, перекись водорода.
3. Коррозионность - способность вещества разрушать или изменять другие материалы. Примеры: кислоты, щелочи.
4. Реакционная способность - скорость и способность вещества взаимодействовать с другими веществами. Примеры: кислотно-щелочные реакции, окислительно-восстановительные реакции.
5. Термическая устойчивость - способность вещества сохранять свои свойства при воздействии высоких температур. Примеры: керамика, нержавеющая сталь.
6. Электропроводность - способность вещества проводить электрический ток. Примеры: металлы, растворы электролитов.
Это только некоторые из множества химических свойств веществ, которые могут ещё и варьировать в зависимости от условий окружающей среды. Они играют важную роль в изучении химии и применяются во многих областях, включая промышленность, медицину и экологию.
Физико-химические свойства веществ: значение и применение

Физико-химические свойства веществ описывают их поведение под воздействием физических и химических процессов. Они включают в себя такие характеристики, как плотность, температура плавления и кипения, растворимость, электропроводность и многие другие.
Значение физико-химических свойств веществ заключается в их использовании для определения и описания химических соединений, а также для предсказания и изучения их поведения в различных условиях.
Применение физико-химических свойств веществ широко распространено в научных и промышленных областях. Например, изучение температуры плавления и кипения позволяет определить условия, при которых вещество переходит из твердого состояния в жидкое или газообразное, что является важной информацией для разработки новых материалов и процессов.
Растворимость вещества в различных растворителях может быть использована для разделения смесей в химическом анализе, а также для определения степени очистки вещества. Электропроводность вещества может быть использована для изготовления электродов, батарей и других электронных устройств.
Физико-химические свойства веществ также являются важными для изучения физических и химических закономерностей природы. Например, изучение свойств веществ позволяет понять, как они взаимодействуют друг с другом, почему определенные химические реакции происходят, а другие нет, и какие особенности имеет строение вещества на молекулярном уровне.
Таким образом, физико-химические свойства веществ имеют большое значение и применение в различных аспектах анализа, производства и научного исследования. Их изучение позволяет расширить наши знания о природе и использовать эти знания для развития новых технологий и материалов.
Органические свойства веществ: особенности и представители
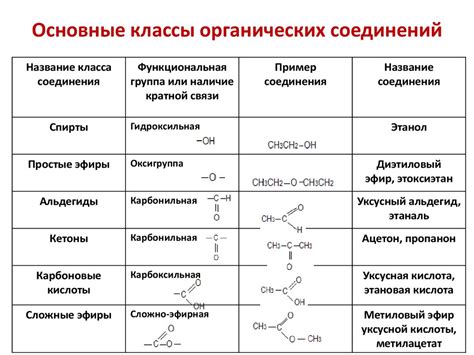
Особенностью органических свойств является их многообразие и разнообразие. Они включают в себя реакционную способность органических соединений, их термическую и химическую стабильность, электрофильность и нуклеофильность, окислительно-восстановительные свойства, кислотно-основные свойства и другие.
Органические свойства веществ имеют практическое значение и используются во многих областях науки и техники. Например, благодаря знанию органических свойств, химики могут создавать новые соединения с нужными свойствами для использования в фармацевтике, пищевой промышленности, электронике и других отраслях.
Представители органических свойств включают такие вещества, как углеводороды, спирты, альдегиды, кетоны, карбоновые кислоты, эфиры, амины, полимеры и многие другие.
Углеводороды – это органические соединения, состоящие только из углерода и водорода. Они делятся на насыщенные и ненасыщенные. Примеры углеводородов: метан, этан, бензол и др.
Спирты – это органические соединения, в которых одна или несколько групп (\-ОН) прикреплены к углеродным атомам. Примеры спиртов: метанол, этанол, глицерин и др.
Альдегиды – это органические соединения, в которых функциональная группа (–CHO) расположена в начале углеводородной цепи. Примеры альдегидов: метаналь, эт
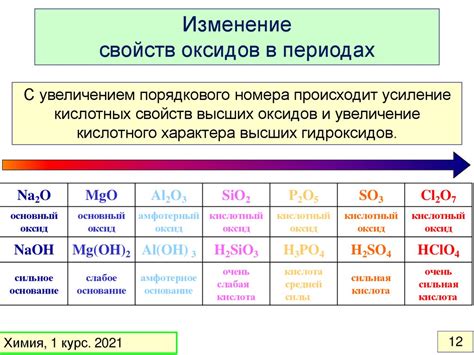
Неорганические свойства веществ: основные характеристики
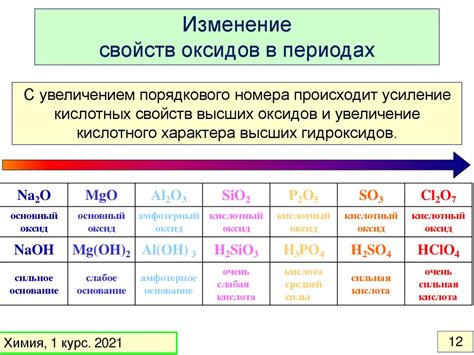
Неорганические свойства веществ в химии относятся к химическим и физическим характеристикам веществ, которые не содержат углерод. Неорганические вещества могут быть металлами, солями, кислотами и основаниями, их свойства обычно определяются атомной структурой и взаимодействием между атомами и молекулами.
Основными неорганическими свойствами веществ являются:
- Растворимость: это способность вещества растворяться в других веществах. Некоторые вещества могут растворяться в воде, образуя гомогенные растворы, в то время как другие вещества не растворяются в воде и образуют нерастворимые осадки.
- Электропроводность: это способность вещества проводить электрический ток. Металлы, кислоты и основания обычно обладают хорошей электропроводностью, тогда как большинство неметаллов имеют низкую электропроводность.
- Кислотность и щелочность: неорганические вещества могут быть кислотами, основаниями или нейтральными. Кислоты имеют кислотные свойства и способность образовывать ион H+, а основания имеют щелочные свойства и способность образовывать ион OH-. Некоторые вещества являются амфотерными и могут образовывать ионы H+ и OH- в зависимости от условий.
- Окислительно-восстановительные свойства: некоторые неорганические вещества могут взаимодействовать с другими веществами, принимая или отдавая электроны. Вещества, которые принимают электроны, считаются окислителями, а вещества, которые отдают электроны, считаются восстановителями.
- Температурные свойства: многие неорганические вещества обладают своеобразными температурными свойствами, такими как точка плавления и кипения. Например, металлы обычно имеют высокие точки плавления и кипения, а некоторые соли имеют низкие точки плавления и кипения.
- Цветность: неорганические вещества могут обладать различным цветом в зависимости от своей структуры и химического состава. Например, переходные металлы могут образовывать соединения разных цветов.
Это лишь некоторые из основных неорганических свойств веществ в химии. Знание этих свойств помогает химикам понять и описать реакции и взаимодействия между различными веществами.
Физические изменения вещества: объяснение и классификация

Физические изменения вещества можно классифицировать на несколько типов в зависимости от их характера.
Первый тип - изменение агрегатного состояния. Вещество может переходить из одного агрегатного состояния в другое при изменении температуры или давления. Например, при нагревании леда он может перейти в жидкое состояние воды, а затем в состояние пара.
Второй тип - изменение размеров и формы. Вещество может менять свои размеры и форму под действием внешних факторов, таких как нагревание или охлаждение. Например, при нагревании металла он может увеличивать свой объем и изменять свою форму.
Третий тип - изменение оптических свойств. Вещество может изменять свой цвет, прозрачность или светоотражающие свойства под воздействием различных факторов, например, при освещении или нагревании.
Четвертый тип - изменение фазового состояния. Вещество может переходить из одной фазы в другую при изменении температуры или давления. Например, вода может переходить из жидкой фазы в паровую или ледяную.
Химические изменения вещества: типы и примеры
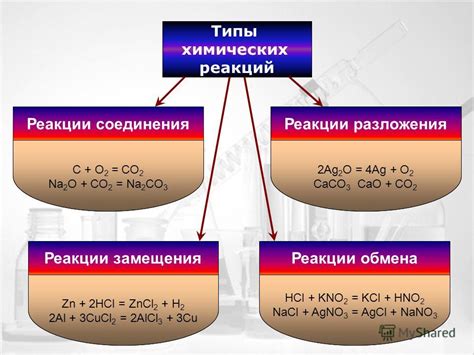
Существует несколько типов химических изменений:
1. Синтез (обратимая реакция).
Синтез - это процесс образования сложных молекул из простых веществ. В результате синтеза образуется новое вещество. Примером синтеза может служить реакция между атомами водорода и кислорода, в результате которой образуется молекула воды:
2H2 + O2 → 2H2O
2. Разложение (обратимая реакция).
Разложение - это процесс распада сложных молекул на более простые вещества. В результате разложения образуются новые вещества. Примером разложения может служить реакция распада перекиси водорода на воду и кислород:
2H2O2 → 2H2O + O2
3. Замещение (необратимая реакция).
Замещение - это процесс, в ходе которого один атом или группа атомов замещаются другими атомами или группами атомов. Примером замещения может служить реакция между медными проводниками и серной кислотой, в результате которой образуется медный соединительный слой:
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
4. Образование осадка (необратимая реакция).
Образование осадка - это процесс образования нерастворимого продукта реакции, который не может быть растворен в реакционной среде. Примером образования осадка может служить реакция между раствором серной кислоты и раствором натрия гидроксида, в результате которой образуется осадок серного ангидрида:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Химические изменения играют ключевую роль в химии, позволяя понять и объяснить различные явления, включая реакции, синтез новых соединений и разложение сложных веществ. Знание типов химических изменений помогает ученым проводить эксперименты и разрабатывать новые материалы и лекарства.
Значение свойств вещества в химических реакциях и промышленности

Свойства веществ имеют важное значение не только в химических исследованиях, но и в промышленности. Они определяют способности вещества изменять свою структуру и взаимодействовать с другими веществами.
В химических реакциях свойства вещества могут определять скорость реакции, температуру, необходимую для проведения реакции, направление реакции и образование продуктов реакции. Например, некоторые вещества обладают высокой активностью в реакциях с кислородом и могут служить хорошими окислителями, тогда как другие вещества могут быть хорошими восстановителями.
В промышленности свойства вещества играют ключевую роль при разработке новых материалов, процессов производства и оптимизации существующих технологий. Например, свойства вещества могут влиять на его прочность, эластичность, теплопроводность, проводимость электричества и другие физические характеристики, что делает его подходящим или неподходящим для конкретного применения. Свойства вещества также могут влиять на его токсичность, стабильность и возможность использования в процессах химической переработки.
Понимание и управление свойствами вещества являются ключевыми факторами в разработке новых материалов с улучшенными характеристиками, обеспечении безопасности процессов и повышении эффективности технологических процессов в промышленности. Изучение свойств вещества позволяет более глубоко понять его природу и принципы его взаимодействия, что полезно не только для химиков и научных исследователей, но и для инженеров и специалистов в области производства.



