Сульфид считается одним из наиболее важных соединений серы, который хорошо известен своими уникальными свойствами и широким спектром применений. В химии сульфиды являются классом соединений, состоящих из сульфидного иона (S2-) и катиона другого элемента. Одним из наиболее распространенных и наиболее исследованных сульфидов является сульфид натрия (Na2S).
Сульфид ион (S2-) представляет собой атом серы со зарядом -2. Это означает, что он имеет две валентные электронные пары. Сульфид ион обладает характерными свойствами, связанными с его структурой и зарядом. Сульфиды обычно образуют прозрачные кристаллы сольного типа, которые имеют низкую температуру плавления и кипения. Сульфид ион также может образовывать сложные соединения с многими металлами и другими ионами.
Сульфид натрия (Na2S) - это солевое соединение, состоящее из двух ионов натрия (Na+) и одного сульфидного иона (S2-). Он обладает сильно щелочными свойствами и широко используется в различных отраслях промышленности. Сульфид натрия используется в качестве депрессанта при обогащении руд, в производстве красителей, фоточувствительных материалов, стекла и мыла. Он также применяется в качестве катализатора в химических реакциях и в процессе синтеза органических соединений.
Сульфид ион и его свойства
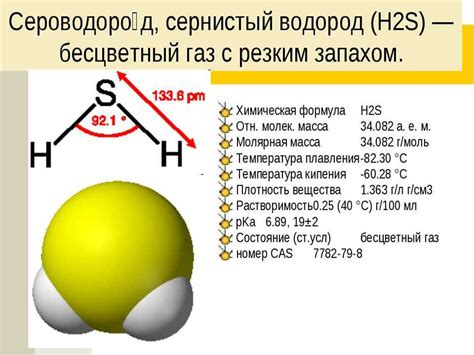
| Свойство | Описание |
|---|---|
| Отрицательная заряд | Сульфид ион имеет заряд -2, что позволяет ему образовывать ионы и соединения с положительно заряженными катионами. |
| Окислительные свойства | Сульфид ион является сильным окислителем и может взаимодействовать с веществом, переходя в молекулярный сероводород (H2S). |
| Образование осадков | Сульфид ион может образовывать темноокрашенные осадки с многими металлами, такими как свинец, ртуть и серебро. |
| Различные применения | Сульфиды используются в производстве стекла, керамики, пигментов и фармацевтических препаратов. Они также широко используются в химической промышленности в качестве катализаторов и реагентов. |
Понятие и определение сульфид иона
Сульфид ион образуется при реакции серы с металлами или при растворении соответствующих солей серы. Он обладает характерным запахом гнилой яиц и является токсичным в больших концентрациях.
Сульфид ион широко используется в различных областях. Он находит применение в производстве веществ, таких как сернистый газ и серная кислота, а также в процессе выделения и обработки цветных металлов.
Из-за своего характерного запаха, сульфид ион также находит применение в лабораторных условиях, где используется для идентификации наличия серы в различных веществах.
Структура и химическая формула сульфид иона
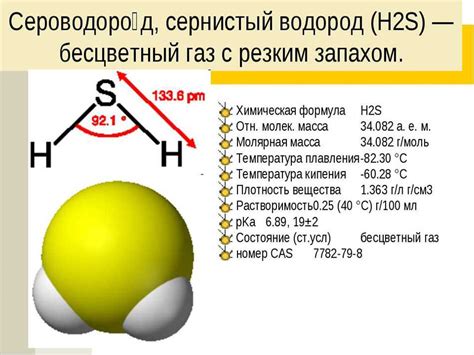
Сульфид ион, обозначаемый символом S2-, представляет собой химическую формулу, обозначающую отрицательно заряженную частицу, состоящую из одного атома серы.
Структура сульфид иона является ионной, так как он состоит из одного атома серы и двух дополнительных электронов. Данные электроны полностью заполняют внешний электронный слой серы, что приводит к образованию устойчивого отрицательного заряда.
Химическая формула сульфид иона показывает наличие двух электронов с отрицательным зарядом. Она может быть записана как S2- или S2-.
Сульфид ион широко используется в различных областях, таких как химическая промышленность, биология и геология. Он может быть использован в качестве реагента, катализатора или применяться в процессах удаления тяжелых металлов из воды или сточных вод.
Свойства сульфид иона
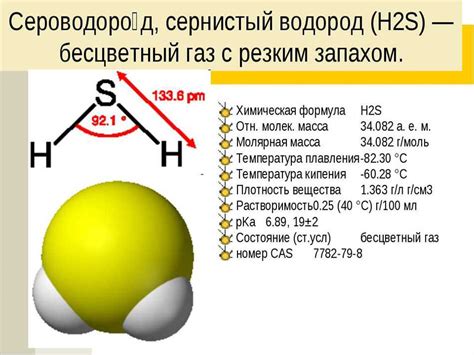
Сульфид ион представляет собой анион, образующийся при диссоциации соответствующих сульфидов. Он обладает следующими свойствами:
| Свойство | Описание |
|---|---|
| Растворимость | Сульфиды растворяются в воде, образуя растворы с щелочной средой. |
| Нестабильность в кислых условиях | Сульфид ион является нестабильным в кислых условиях, при контакте с кислотами он окисляется до сульфата. |
| Отрицательный заряд | Сульфид ион имеет отрицательный заряд, равный -2. |
| Образование осадков | При реакции сульфидного иона с катионами многих металлов образуются темные осадки сульфидов. |
| Индикатор | Сульфид ионы могут служить индикатором наличия некоторых металлов в растворе, используя реакцию образования осадка. |
Сульфид ион имеет большое значение в различных областях науки и техники. Например, его применяют в гальванических элементах, металлургии, а также в производстве красителей и пигментов.
Реакция сульфид иона с катионом натрия

Когда сульфид ион и катион натрия встречаются, они могут образовывать такие соединения, как сульфид натрия (Na2S) и гидросульфид натрия (NaHS). Реакция между сульфид ионом и катионом натрия происходит по следующей схеме:
- Сульфид ион (S2-) получает одно или два электрона от катиона натрия (Na+).
- Формируются соединения с различными степенями окисления серы, в зависимости от количества электронов, переданных от катиона натрия.
Применение реакции между сульфид ионом и катионом натрия может быть разнообразным. Например, сульфид натрия используется в производстве стекла, консервировании пищевых продуктов, в процессе обработки руды и производства цветных металлов. Гидросульфид натрия может использоваться в качестве отбеливающего и дезинфицирующего средства, а также в производстве красителей и косметических продуктов.
Таким образом, реакция между сульфид ионом и катионом натрия имеет большое значение в химической промышленности и обладает широким спектром применения.
Топливные свойства сульфид иона
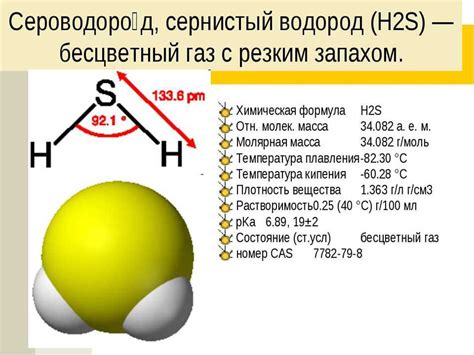
Сульфид ион может быть использован в качестве источника формального водорода (H2) при взаимодействии с катионами натрия (Na+). В реакции получается гидрохсид натрия (NaOH) и сероводород (H2S), который используется в качестве топлива.
Сероводород является весьма эффективным топливом, поскольку при сжигании выделяет большое количество тепла. Кроме того, сероводород почти полностью сгорает, отводя жар от пламени и позволяя его использовать в различных видов топлива, включая горючие газы, бензин и даже ракетные топлива.
Примечание: Сероводород является высокотоксичным и опасным веществом, поэтому при работе с ним необходимо соблюдать все соответствующие меры предосторожности и распорядок работы.
Катион натрия и его свойства

Вот некоторые из ключевых свойств катиона натрия:
- Натрий является мягким металлом с блестящей поверхностью.
- Он имеет низкую плотность и низкую температуру плавления.
- Катион натрия обладает высокой реактивностью и быстро окисляется на воздухе.
- Натрий образует стабильные соединения с различными анионами, включая хлориды, сульфаты, карбонаты и многое другое.
- Катион натрия обладает способностью образовывать растворы, которые хорошо проводят электричество.
- Натрий имеет особую роль в живых организмах, где он является одним из основных электролитов и участвует во многих биологических процессах.
Эти свойства натрия делают его незаменимым в промышленном и научном мире. Катион натрия используется в производстве стекла, мыла, щелочи, лекарств и многих других продуктов.
Важно отметить, что натрий также играет роль в регулировании баланса воды и электролитов в организме человека, и его наличие в пище является необходимым для поддержания нормальной функции органов и систем.
Структура и химическая формула катиона натрия
Структура катиона натрия связана с его электронной конфигурацией. В основном состоянии натрий имеет 11 электронов, распределенных по энергетическим уровням. На внешнем энергетическом уровне находится один электрон, который легко отделяется, образуя положительный ион.
Катион натрия широко используется в различных промышленных процессах и бытовых сферах. Он является важным компонентом в составе соли, используется в производстве стекла, щелочей, моющих средств и других продуктов.
Реакция катиона натрия со сульфид ионом

Реакция протекает по следующей схеме:
- Сульфид ион (S2-) и катион натрия (Na+) вступают в реакцию.
- Сульфид ион (S2-) передает два электрона катиону натрия (Na+), образуя нейтральную молекулу сульфида натрия (Na2S).
- Реакция сопровождается освобождением энергии и образованием ионных связей между атомами натрия и атомами серы.
Сульфид натрия (Na2S) - прочное, белое кристаллическое вещество, растворимое в воде. Он широко используется в различных отраслях промышленности, таких как производство бумаги, кожи, стекла, а также в химической и фармацевтической промышленности.
Применение сульфид иона и катиона натрия

Сульфид ион (S2-) широко применяется в процессах синтеза и производства соединений, таких как сульфиды металлов, важные компоненты в различных отраслях химической промышленности. Например, сульфид кадмия (CdS) используется в солнечных батареях и светодиодах благодаря своим полупроводниковым свойствам. Сульфид кальция (CaS) применяется в производстве фармацевтических препаратов и косметических продуктов. Кроме того, сульфид ион также может использоваться в процессах очистки и обеззараживания воды.
Катион натрия (Na+) широко применяется в пищевой промышленности, медицине и химической промышленности. Натрий является одним из основных элементов, необходимых для поддержания нормальной работы организма и сохранения жизненных функций. Катион натрия используется в качестве добавки в пищу для улучшения вкусовых качеств продуктов. Он также может быть использован в процессах очистки воды, производстве мыла, стекла и других химических соединений.
Сульфид ион и катион натрия играют существенную роль в различных областях и научных исследованиях, обеспечивая основу для создания новых материалов, препаратов и технологий.
Использование в промышленности

Сульфид ион и катион натрия имеют широкое применение в различных отраслях промышленности.
- Химическая промышленность: Сульфид ион используется в производстве серы и сернистого ангидрида, которые широко применяются в производстве удобрений, жидкого стекла, оксидов и многих других химических соединений.
- Металлургическая промышленность: Натриевый сульфид используется в процессе обогащения руды, а также в производстве черных металлов и некоторых сплавов.
- Кожевенная промышленность: Сульфид ион и катион натрия используются для обработки сырья в процессе крашения, дубления и выделки кожи.
- Нефтегазовая промышленность: Сульфид ион используется для удаления серы из нефти и газа в процессе очистки и десульфурации.
Использование сульфид иона и катиона натрия в промышленности позволяет существенно улучшить процессы производства, повысить качество готовой продукции и снизить вредные воздействия на окружающую среду.



