Атомное ядро является одной из основных составных частей атома и представляет собой невероятно маленькую и плотную область, находящуюся в его центре. Оно содержит положительно заряженные частицы, называемые протонами, и нейтральные частицы, называемые нейтронами. Вместе протоны и нейтроны образуют ядро атома.
Протоны являются основными носителями положительного заряда в атоме и определяют его химические свойства. Число протонов в ядре определяет атомный номер элемента и обозначается символом Z. Протоны располагаются очень плотно в ядре и взаимодействуют друг с другом через сильное ядро, но отталкиваются друг от друга из-за их одинакового положительного заряда. Нейтроны, напротив, не несут заряда, и их главная функция - создание стабильности ядра путем уравновешивания отталкивающих сил между протонами.
Наличие протонов и нейтронов в атомном ядре весьма важно для его структуры и устойчивости. Число протонов в ядре определяет химические свойства элемента, а число нейтронов влияет на его ядерные свойства, включая его массу и стабильность. Элементы, которые имеют одинаковое количество протонов, но отличаются числом нейтронов в своих ядрах, называются изотопами. Изотопы одного элемента имеют одинаковый атомный номер, но разный атомный массовый номер. Изотопы могут быть стабильными или нестабильными, и последние могут распадаться с течением времени, выбрасывая частицы и излучение.
Определение атомного ядра
Ядро обладает очень высокой плотностью - протоны и нейтроны сосредоточены на очень маленьком пространстве. Диаметр атомного ядра составляет всего несколько фемтосекунд, в то время как диаметр атома весьма значительно больше. Таким образом, большая часть объема атома пуста, и вся его масса концентрируется в ядре.
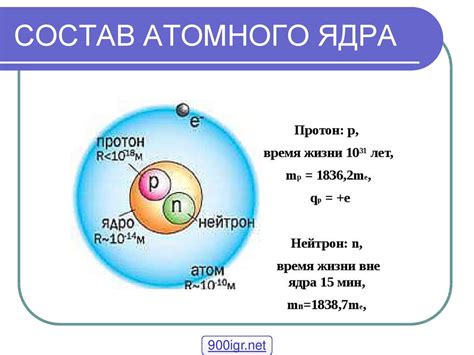
Протоны и нейтроны называются нуклонами и являются фундаментальными частицами элементарной частицы. Протоны и нейтроны имеют примерно одинаковую массу, но протоны обладают положительным зарядом, а нейтроны не имеют зарядов.
Число протонов в ядре называется атомным номером и определяет химические свойства атома. Например, для атома водорода атомный номер равен 1, что значит, что в его ядре содержится один протон. Атомные номера для различных элементов приведены в периодической системе химических элементов.
Ядра атомов могут иметь различное количество нейтронов, что влияет на их массу. Атомы с одинаковым атомным номером, но различным числом нейтронов, называются изотопами. Изотопы обладают схожими химическими свойствами, но могут иметь различные физические свойства, такие как масса и радиоактивность.
Построение атомного ядра
Атомное ядро имеет положительный заряд из-за протонов, которые имеют положительный электрический заряд. Нойтроны в ядре не имеют заряда, но оказывают важное влияние на его стабильность.
Главным фактором, определяющим стабильность ядра, является баланс между электростатическим отталкиванием протонов и силой притяжения между протонами и нейтронами (силой ядерного взаимодействия).
Процесс построения атомного ядра происходит в несколько этапов. Сначала происходит синтез легких элементов в звездах при высоких температурах и давлениях. Затем, в результате взаимодействия различных элементарных частиц в звездах и в самом пространстве, происходит формирование более тяжелых элементов.
При формировании ядра важные роли играют фундаментальные силы, такие как электромагнитная сила и сильная ядерная сила. Электромагнитная сила обладает свойством отталкивания протонов, что может привести к нестабильности ядра. Сильная ядерная сила, наоборот, обеспечивает стабильность ядра и является основной силой, притягивающей нуклоны (протоны и нейтроны).
Интересно, что есть множество возможных комбинаций протонов и нейтронов, которые могут образовывать стабильные ядра. Это объясняет, почему мы можем наблюдать такое разнообразие элементов и их изотопов в природе.
Протоны и нейтроны
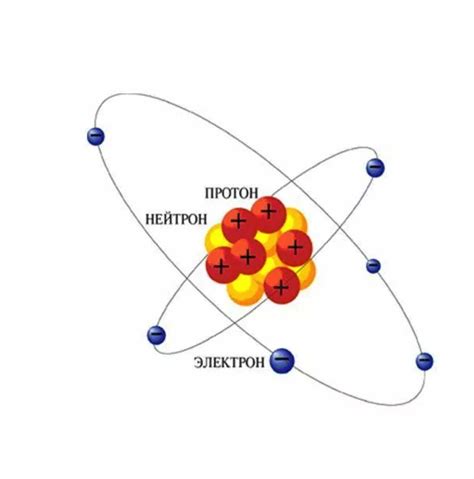
Атомное ядро состоит из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Оба этих типа частиц называют нуклонами.
Протоны и нейтроны имеют примерно одинаковую массу и считаются частицами фундаментального строения атомного ядра.
Протоны определяют химические свойства элемента, так как количество протонов в атоме определяет его атомный номер. Нейтроны не имеют электрического заряда и вносят вклад в ядро только своей массой.
Сумма протонов и нейтронов в ядре определяет его массовое число, которое также является характеристикой элемента.
Электроны и атомное ядро
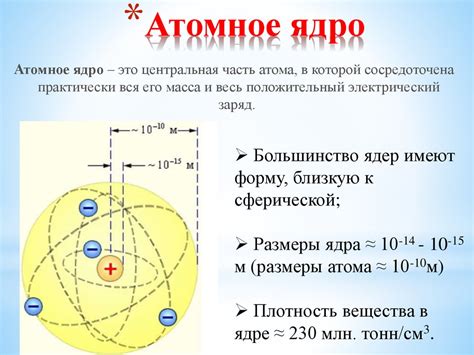
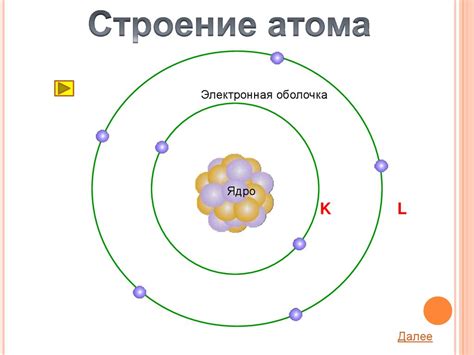
Электроны и атомное ядро составляют основу структуры атома. Атом представляет собой один из основных строительных блоков вещества и состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, которые называются нуклонами.
Протоны – одна из фундаментальных частиц атомного ядра, имеющая положительный электрический заряд. Обычно количество протонов в ядре определяет элемент и его порядковый номер в периодической системе.
Нейтроны – нейтральные по заряду частицы, также являющиеся составными частями атомного ядра. Они осуществляют силовое взаимодействие между протонами, что сохраняет ядро стабильным.
Электроны – негативно заряженные элементарные частицы, находящиеся вокруг атомного ядра в определенных энергетических уровнях или оболочках. Количество электронов в атоме равно количеству протонов, что обеспечивает электрическую нейтральность атома.
Электроны и ядро взаимодействуют друг с другом. Сила притяжения между ядром и электронами называется кулоновским взаимодействием. Электростатические силы исключительно важны для определения структуры атома и его свойств.
Строение и свойства атомного ядра
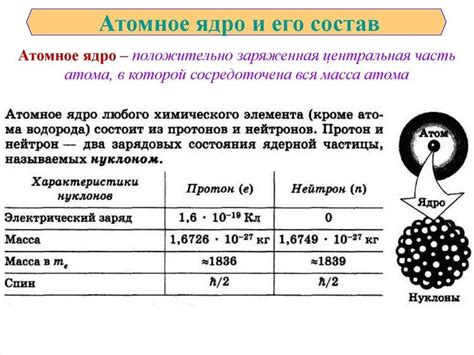
Протоны и нейтроны называются нуклонами. Они находятся в ядре благодаря сильным взаимодействиям, которые совершенно преобладают над электростатическим отталкиванием протонов.
Число протонов в ядре определяет химические свойства атома и называется атомным номером. Обозначается символом Z. Например, у водорода атомный номер равен 1, а у углерода - 6.
Число нейтронов в ядре может варьироваться у атомов одного и того же элемента. Сумма протонов и нейтронов определяет атомную массу атома и обозначается символом A. Например, у обычного водорода атомная масса равна 1, а у углерода - 12.
Протоны и нейтроны, находящиеся в ядре, обладают нуклеонным числом, обозначаемым символом N. Оно равно сумме протонов и нейтронов в ядре.
В ядре присутствует также энергия связи, которая обеспечивает его стабильность. Энергия связи это энергия, необходимая для разделения ядра на отдельные нуклоны. Чем больше энергия связи, тем стабильнее ядро.
Структура и свойства атомного ядра играют важную роль в химических реакциях и влияют на многие физические и химические процессы. Понимание этих свойств позволяет лучше понять и объяснить множество явлений и является основой для развития ядерной физики и ядерной энергетики.
| Свойство | Значение |
|---|---|
| Протоны | имеют положительный электрический заряд |
| Нейтроны | не имеют заряда |
| Атомный номер | определяет химические свойства атома |
| Атомная масса | сумма протонов и нейтронов в ядре |
| Нуклеонное число | сумма протонов и нейтронов в ядре |
| Энергия связи | энергия, необходимая для разделения ядра |
Изменение структуры ядра
Разложение атомного ядра
Во время некоторых физических процессов атомные ядра могут изменять свою структуру путем разложения на более простые составляющие. Этот процесс называется ядерным распадом. Ядерный распад может происходить спонтанно или быть вызванным внешними воздействиями, такими как возмущение атомного ядра в результате взаимодействия с другими частицами или излучения.
Разные виды ядерного распада
Существует несколько различных видов ядерного распада, включая альфа-распад, бета-распад и гамма-распад. В альфа-распаде ядро испускает частицу альфа, состоящую из двух нейтронов и двух протонов. В бета-распаде ядро испускает электрон или позитрон, а гамма-распад связан с испусканием гамма-излучения высокой энергии.
Процесс ядерного синтеза
Обратным процессом к ядерному распаду является ядерный синтез, при котором более легкие ядра объединяются для образования более тяжелых ядер. Ядерный синтез является основным процессом, который происходит в звездах, включая наше Солнце. В результате ядерного синтеза высвобождается большое количество энергии.
Изучение изменений в структуре атомного ядра играет важную роль во многих областях, включая ядерную физику, астрофизику и медицину.
Роль атомного ядра в химических процессах

Атомное ядро играет важную роль в химических процессах, определяя свойства и химическую активность атомов. Ядро состоит из протонов и нейтронов, причем количество протонов определяет химический элемент, а количество нейтронов влияет на изотопический состав.
Протоны в ядре обладают положительным зарядом, который привлекает электроны, находящиеся на энергетических оболочках атома. Это приводит к образованию химических связей между атомами и возникновению разнообразных химических соединений. Отношение между протонами и электронами определяет химическую активность атома и его способность взаимодействовать с другими атомами.
Ядро также определяет массу атома и его стабильность. Нейтроны в ядре играют роль буфера, нейтрализуя отталкивающие силы между протонами и удерживая их вместе. Количество нейтронов влияет на стабильность ядра: избыток или недостаток нейтронов может привести к радиоактивному распаду ядра.
Реакции химического взаимодействия между атомами происходят за счет изменения расположения, обмена или передачи электронов между атомами. Однако, ядра атомов в химических реакциях остаются нетронутыми, так как силы взаимодействия между ними гораздо слабее, чем силы взаимодействия между электронами. Это объясняет почему химические реакции не влияют на создание новых ядерных соединений.
Изучение структуры и свойств атомного ядра позволяет углубить понимание процессов, происходящих в химии. Это является основой для дальнейшего развития технологий и приложений в различных областях, таких как энергетика, медицина, материаловедение и другие.