Хлор (Cl) - химический элемент из группы галогенов, относится к неметаллам. В природе хлор встречается в виде солей, главным образом в виде хлорида натрия (NaCl). Хлор обладает характерными свойствами, благодаря которым он находит широкое применение в различных сферах, включая производство пластмасс, дезинфекцию воды и участие в химических реакциях.
Хлор образует ковалентные полярные связи с определенными элементами, которые обладают высокой электроотрицательностью. Такие связи образуются, когда два атома разделяют одну или несколько пар электронов. В результате образуются молекулы, в которых электроны неоднородно распределены и имеют различную электронную плотность. Это свойство придаёт молекулам полярность.
Примером такой связи является соединение хлора с кислородом (O), образовавшее молекулу хлорида кислорода (ClO). В этой молекуле хлор образует ковалентную связь с кислородом, однако электроны в этой связи между атомами неоднородно распределены. Из-за различия в электроотрицательности атомов хлора и кислорода, электроны проводимости смещаются ближе к кислороду, что придаёт молекуле полярность и заряжённость.
Таким образом, хлор образует ковалентные полярные связи с элементами высокой электроотрицательностью, такими как кислород, ионный радикал фтора (F) и другими. Эти связи обладают уникальными свойствами и находят широкое применение в химической промышленности и других сферах.
Источники хлора и его химические свойства
Хлор - легкого желтовато-зеленого цвета газ с характерным запахом, обладающий высокой реактивностью. Он является одним из наиболее распространенных элементов в земной коре, а его компоненты широко используются в различных отраслях промышленности и научных исследований.
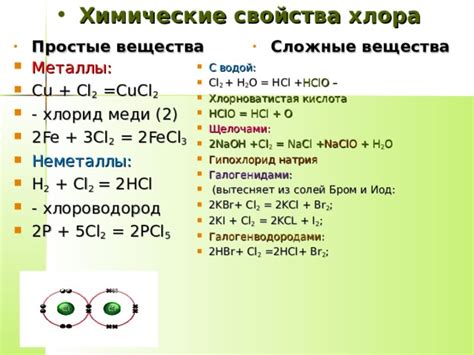
Хлор обладает высокой электроотрицательностью, что позволяет ему образовывать ковалентные полярные связи с другими элементами. В своей атомной структуре хлор имеет семь электронов на внешней оболочке, а его октетный оксидационный статус делает его готовым к образованию связей с другими элементами, чтобы завершить его электронную оболочку.
Хлор также образует ковалентные полярные связи с элементами в неорганических соединениях, таких как хлориды, где он принимает электроотрицательность и приводит к образованию положительно заряженных катионов и отрицательно заряженных анионов.
Хлор используется в различных промышленных процессах, таких как производство пластмасс, промышленные очистные процессы и производство различных химических соединений. Он также широко используется в обработке воды, в медицине как дезинфицирующее средство, а также в процессе производства пестицидов и хлорсодержащих химических соединений.
Свойство хлора образовывать ковалентные полярные связи является одним из основных причин его широкого использования в различных областях исследований и промышленности.
Ковалентные связи: определение и принцип работы
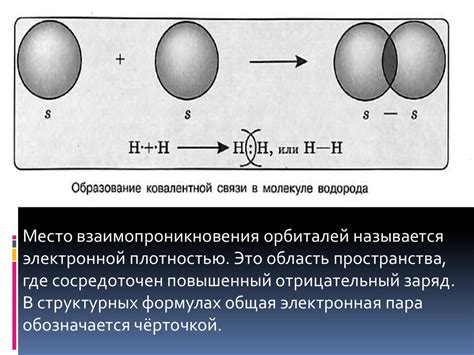
Работа ковалентной связи основана на принципе совместного использования электронов. Когда атомы образуют ковалентную связь, их внешние электронные оболочки перекрываются, что позволяет электронам переходить между атомами и образовывать общую пару электронов.
| Пример | Объяснение |
|---|---|
| Хлор (Cl) и водород (H) | Атом хлора имеет 7 электронов во внешней оболочке, а водорода - 1 электрон. Чтобы достичь стабильности, атом хлора нуждается в еще одном электроне, а атом водорода - в одном дополнительном электроне. Когда хлор и водород образуют молекулу HCl, электрон из внешней оболочки атома хлора переходит к атому водорода. Оба атома теперь имеют полную оболочку, и связь становится ковалентной. |
Полярность ковалентных связей между атомами указывает на то, как электроны в связи распределены. В случае соединения хлора (Cl2), два атома хлора равномерно делят пару электронов и связь является неполярной. Однако, в некоторых случаях, электроны могут быть неодинаково распределены, что приводит к образованию полярных ковалентных связей. Например, в молекуле HCl электроны более сильно притягивают к себе атом хлора, в результате чего электроны проводимости смещаются в сторону хлора и связь становится полярной.
Что такое полярные связи и их особенности

Особенности полярных связей:
| Особенность | Описание |
|---|---|
| Полярный характер | В полярных связях одна сторона молекулы имеет небольшой отрицательный заряд, а другая – небольшой положительный заряд. |
| Направленность | Полярные связи имеют конкретное направление, обусловленное различной силой притяжения атомов. |
| Влияние на физические свойства | Полярные связи влияют на такие физические свойства молекулы, как ее растворимость, температура плавления и кипения и т.д. |
| Образование диполя | Полярная связь приводит к образованию молекулярного диполя – момента электрического заряда, обусловленного неравномерным распределением электронной плотности. |
Примером полярной связи может служить образование ковалентной полярной связи между атомами хлора (Cl) и другим атомом, например, кислородом (O). В этом случае атом хлора привлекает электроны в более сильной степени, образуя небольшой отрицательный заряд, в то время как атом кислорода имеет небольшой положительный заряд.
Хлор как элемент и его свойства

Хлор - желтовато-зеленый газ с неприятным запахом. Он является довольно активным элементом, который легко образует соединения с другими элементами. Хлор часто встречается в природе в виде хлорида натрия (NaCl), который является основным компонентом каменной соли.
Свойства хлора:
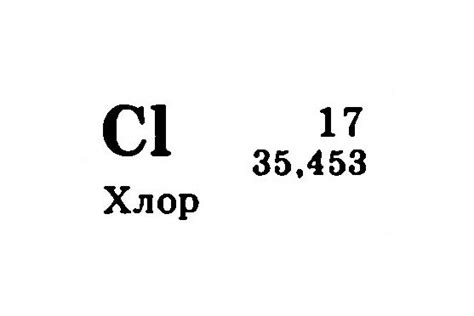
- Атомный номер: 17
- Атомная масса: 35,453 г/моль
- Плотность: 3,214 г/см³
- Температура плавления: -101,5 °C
- Температура кипения: -34,04 °C
Хлор является крайне важным элементом для жизнедеятельности организмов. В частности, он необходим для образования хлороводородной кислоты в желудочно-кишечном тракте.
Хлор широко используется в промышленности, особенно в химической и пищевой отрасли. Он применяется при производстве пластмасс, поливинилхлорида (PVC), белков, бумаги и многих других продуктов.
Реакция хлора с другими элементами: образование ковалентных связей
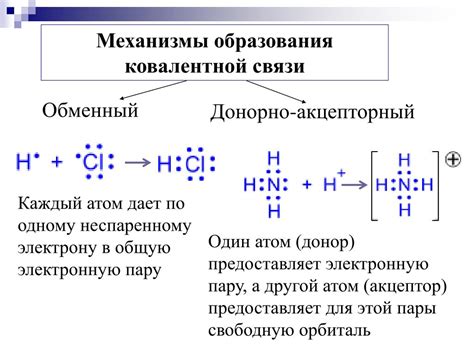
Ковалентная связь – это тип химической связи, в которой электроны обмениваются между атомами. При реакции хлора с другими элементами, каждый атом хлора делится со своими соседними атомами по одной паре электронов, что позволяет им заполнить внешние энергетические уровни и достичь стабильности. В результате образуются стабильные молекулы соединений с ковалентными полярными связями.
Хлор может образовывать ковалентные связи с атомами других неметаллов, таких как водород, кислород, азот, сера, фосфор и др. Например:
- В реакции с водородом (H) образуется хлороводородная кислота (HCl).
- При взаимодействии с кислородом (O) образуется хлорид кислорода (ClO).
- С азотом (N) хлор образует хлорид азота (ClN).
- Сер (S) реагирует с хлором, образуя хлорид серы (S2Cl2).
Эти связи являются полярными, так как электроны в них не равномерно распределены и обуславливают образование положительных и отрицательных зарядов между атомами. Такие ковалентные связи характеризуются высокой электроотрицательностью хлора и других элементов, с которыми он реагирует.
Важно отметить, что реакция хлора с другими элементами может протекать в различных условиях и давать разнообразные продукты. Эти реакции имеют огромное значение во многих областях химии и применяются в промышленности, медицине, сельском хозяйстве и других отраслях науки и техники.
Образование полярных связей при реакции хлора с определенными элементами
Полярная ковалентная связь образуется, когда электроны в молекуле не равномерно распределены между атомами. В случае хлора, он имеет семь электронов во внешнем энергетическом уровне, а его электроотрицательность равна 3,16 по шкале Полинга.
При реакции с водородом, хлор получает один электрон от молекулы водорода, образуя положительно заряженный ион хлорида (Cl-) и отрицательно заряженный ион водорода (H+). Этот ионизованный водород может образовывать водородные связи с другими молекулами.
Когда хлор реагирует с кислородом, он получает два электрона от молекулы кислорода, образуя ион хлорида (Cl-) и отрицательно заряженный ион оксида (O2-). Эти ионы могут образовывать ионные связи с другими атомами.
Реакция хлора с фтором аналогична реакции с кислородом и приводит к образованию иона хлорида (Cl-) и отрицательно заряженного иона фторида (F-). Эти ионы также могут образовывать ионные связи с другими атомами.
При реакции хлора с азотом, хлор получает три электрона от молекулы азота, образуя ион хлорида (Cl-) и отрицательно заряженный ион азида (N3-). Ионы азида могут образовывать ионные связи с другими атомами.
Эти полярные ковалентные связи сопровождаются обменом электронами между атомами, что приводит к образованию ионов с разными зарядами. Эта реакция позволяет хлору и другим элементам образовывать стабильные молекулы и ионы, которые имеют различные химические свойства и способствуют различным химическим реакциям.
Примеры важных соединений, образующихся при взаимодействии хлора с другими элементами и обладающих полярными связями

1. Хлороводород (HCl)
Одним из основных соединений, образующихся взаимодействием хлора с водородом, является хлороводород (HCl). Это газообразное вещество, обладающее ярко выраженным запахом и кислотными свойствами. Хлороводород широко используется в химической промышленности для производства различных хлорсодержащих соединений, таких как хлорные извести и поливинилхлорид, которые находят применение в производстве пластиков и других материалов.
2. Хлорид натрия (NaCl)
В результате реакции хлора с натрием образуется хлорид натрия (NaCl) - соль, широко распространенная в природе и известная нам как обычная поваренная соль. Хлорид натрия также является важным реагентом в химической лаборатории и применяется в многих промышленных процессах, включая производство стекла, текстиля, металлургии и пищевой промышленности.
3. Хлорфторуглероды (CFCs)
Хлорфторуглероды (CFCs) - это класс органических соединений, содержащих хлор, фтор и углерод. Они используются в качестве хладагентов, растворителей и пропеллантов. Однако, из-за своего негативного воздействия на озоновый слой, использование CFCs было сильно ограничено в соответствии с Протоколом о веществах, разрушающих озоновый слой.
4. Хлорпикрин (C6H3Cl3NO2)
Хлорпикрин - это ядовитое и едкие соединение, используемое в качестве инсектицида и химического оружия. Оно образуется при взаимодействии хлора с глицерином и концентрированными кислотами. Хлорпикрин сильно раздражает глаза и дыхательные пути, и его использование сильно ограничено из-за его опасных свойств.
Это лишь некоторые примеры соединений, образующихся при взаимодействии хлора с другими элементами и обладающих полярными связями. Хлор имеет широкий спектр реакций с другими веществами, что делает его одним из наиболее важных элементов в химической промышленности и науке.