Скорость химической реакции - это один из важных понятий изучаемых в курсе химии в 9 классе. В химии скорость химической реакции показывает, с какой скоростью протекает процесс превращения исходных веществ в конечные продукты. Скорость может быть различной, и она зависит от ряда факторов, таких как концентрация реагирующих веществ, температура, наличие катализаторов и т.д.
Скорость химической реакции является важной характеристикой для понимания и описания процессов, которые происходят в химических системах. Она позволяет определить, насколько быстро или медленно происходят превращения веществ, и какие факторы могут повлиять на этот процесс.
Студентам 9 класса часто задаются вопросы, связанные со скоростью химической реакции. Каковы факторы, влияющие на скорость реакции? Как изменяется скорость при изменении концентрации или температуры? Как катализаторы могут повысить скорость реакции? Ответы на эти вопросы отражают основы теории скорости реакции и помогут в понимании множества химических процессов, которые окружают нас в повседневной жизни.
Сущность скорости химической реакции

Скорость химической реакции может зависеть от различных факторов, таких как температура, концентрация реагентов, поверхность контакта, катализаторы и растворители. Изменение любого из этих факторов может повлиять на скорость реакции.
Скорость химической реакции может быть определена экспериментально с помощью методов, таких как измерение изменения концентрации реагентов или продуктов во времени или использование специальных индикаторов реакции.
Знание скорости химической реакции позволяет ученым лучше понять кинетику химических процессов, оптимизировать промышленные процессы, разрабатывать новые лекарственные препараты и материалы, а также исследовать различные природные и химические процессы.
Определение скорости химической реакции

Скорость химической реакции может быть выражена в разных единицах, например, в молях вещества, потребляемых или образующихся за единицу времени, в граммах вещества или даже в единицах измерения, специфичных для конкретной реакции.
Скорость химической реакции зависит от различных факторов, таких как концентрация реагентов, температура, присутствие катализаторов и поверхности взаимодействующих веществ. Например, повышение концентрации реагентов или температуры обычно приводит к увеличению скорости реакции.
Определение скорости химической реакции может проводиться различными методами. Одним из них является метод моментальной смеси, при котором реагенты смешиваются в момент времени t=0 и затем определяется изменение концентрации реагентов или продуктов по прошествии определенного времени.
Другим методом определения скорости химической реакции является метод непрерывного изменения концентрации, при котором реакция проводится в специальном сосуде, в котором заранее известны начальные концентрации реагентов, а затем определяется изменение концентрации вещества во времени.
Определение скорости химической реакции является важным аспектом изучения химии и позволяет понять, как изменения различных факторов влияют на скорость протекания химических реакций.
Факторы, влияющие на скорость химической реакции
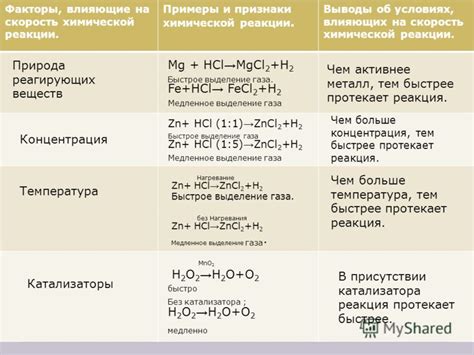
1. Концентрация реагентов
Одним из основных факторов, влияющих на скорость химической реакции, является концентрация реагентов. Чем выше концентрация реагентов, тем больше столкновений между частицами и, следовательно, увеличивается вероятность их взаимодействия. Это приводит к увеличению количества проходящих реакций за единицу времени и, соответственно, к увеличению скорости реакции.
2. Температура
Температура является еще одним важным фактором, влияющим на скорость химической реакции. Повышение температуры приводит к увеличению средней кинетической энергии молекул реагентов, что увеличивает вероятность успешных столкновений и скорость реакции. Поэтому при повышении температуры скорость химической реакции обычно увеличивается.
3. Поверхность реагентов
Поверхность реагентов также оказывает влияние на скорость химической реакции. Если поверхность реагентов увеличена, то увеличивается площадь контакта между их частицами, что способствует увеличению количества столкновений и, соответственно, скорости реакции.
4. Использование катализаторов
Катализаторы - это вещества, которые ускоряют химические реакции, не участвуя в них самостоятельно. Они позволяют снизить энергию активации реакции, что увеличивает скорость реакции. Катализаторы повышают эффективность столкновений между реагентами, способствуя образованию транситных комплексов и продуктов реакции.
5. Давление
Давление влияет на скорость газовых реакций. При увеличении давления повышается частота столкновений между частицами реагентов, что приводит к увеличению скорости реакции.
6. Эффект Маттега
Эффект Маттега заключается в том, что при увеличении концентрации реакционных частиц медленная реакция может ускориться. Причина этого эффекта заключается в формировании насыщенных слоев или комплексных соединений, которые способствуют более быстрой реакции.
Указанные факторы являются лишь некоторыми из множества, влияющего на скорость химической реакции. В реальности существует множество других факторов, например, физическое состояние реагентов, свет, наличие ингибиторов и т. д., которые также могут оказывать влияние на скорость реакции. Комплексное взаимодействие всех этих факторов определяет скорость протекания химической реакции.
Концентрация веществ и скорость реакции

Изменение концентрации вещества может оказать существенное влияние на скорость химической реакции. Повышение концентрации вещества приводит к увеличению коллизий между молекулами или ионами, что способствует увеличению вероятности успешного соударения и образования новых частиц.
Закон сохранения массы устанавливает, что сумма концентраций реагентов и продуктов в химической реакции остается неизменной в течение всей реакции. Однако, в начале реакции концентрация реагентов высока, а концентрация продуктов низка. По мере протекания реакции происходит уменьшение концентрации реагентов и увеличение концентрации продуктов.
Повышение концентрации реагентов увеличивает число частиц, способных претерпеть реакцию, и, следовательно, увеличивает вероятность возникновения успешных столкновений. В результате, скорость реакции возрастает.
Определение концентрации вещества может осуществляться различными способами, такими как измерение массы с использованием баланса, измерение объема с помощью мерных цилиндров или использование методов спектрофотометрии.
Таким образом, концентрация вещества играет важную роль в определении скорости химической реакции. Повышение концентрации реагентов приводит к ускорению реакции, в то время как снижение концентрации может замедлить процесс образования новых частиц.
Температура и скорость реакции

Это происходит из-за того, что при повышении температуры молекулы вещества получают больше энергии и начинают двигаться быстрее. Это увеличивает количество столкновений между молекулами, что в свою очередь увеличивает вероятность успешного протекания реакции.
Важно отметить, что реакции могут иметь различные температурные интервалы, в которых они происходят. Некоторые реакции могут быть очень медленными при комнатной температуре, но становиться значительно быстрее при нагревании. В других случаях, реакции могут быть обратимыми и скорость реакции может увеличиваться, а затем уменьшаться при повышении температуры.
Таким образом, понимание взаимосвязи между температурой и скоростью реакции является важным шагом для изучения химических процессов и определения оптимальных условий для проведения реакции.
Катализаторы и их роль в ускорении химических реакций

Основной механизм действия катализаторов заключается в снижении энергетического барьера для протекания реакции. Катализаторы обладают свойством увеличивать скорость реакции путем активации молекул исходных веществ. Это достигается за счет изменения пути реакции и образования промежуточных соединений, которые обладают более низкой энергией активации.
| Примеры катализаторов | Реакции, в которых используются |
|---|---|
| Ферменты | Биохимические реакции в организмах |
| Металлы | Реакции окисления-восстановления |
| Кислоты и основания | Реакции нейтрализации |
| Платина | Реакции гидрирования |
В химической промышленности катализаторы широко применяются для ускорения реакций и повышения эффективности процессов. Катализаторы позволяют значительно сократить время реакции, что снижает затраты на производство и повышает его эффективность.
Использование катализаторов также может быть экологически более благоприятным, поскольку часто они позволяют проводить реакции при более низких температурах и с использованием меньших количеств химических веществ. Это помогает сократить выделение вредных веществ в окружающую среду.
Физическое состояние веществ и скорость реакции

Физическое состояние веществ, такое как твердое, жидкое или газообразное, оказывает влияние на скорость химической реакции. Молекулы веществ имеют разную подвижность и взаимодействуют друг с другом по-разному в зависимости от их состояния.
В газообразных веществах молекулы свободно движутся и могут сталкиваться между собой чаще, чем молекулы в твердых или жидких веществах. Это объясняет, почему большинство газовых реакций протекают быстрее, чем реакции с участием твердых или жидких веществ.
Жидкости имеют более ограниченную свободу движения молекул, так как они плотно соседствуют друг с другом. Однако, по сравнению с твердыми веществами, молекулы в жидкостях все равно имеют большую подвижность и частоту столкновений, что влияет на скорость реакции.
В твердых веществах молекулы обычно организованы в регулярные структуры, что делает их движение ограниченным и снижает частоту столкновений. Поэтому реакции, которые требуют разрушение или изменение этой структуры, могут происходить медленнее в сравнении с реакциями в газообразных или жидких веществах.
Следует отметить, что физическое состояние вещества не является единственным фактором, влияющим на скорость реакции. Другие факторы, такие как концентрация реагентов, температура, поверхность контакта и присутствие катализаторов, также могут существенно влиять на скорость химической реакции.
| Физическое состояние | Примеры веществ |
|---|---|
| Твердое | Металлы, минералы |
| Жидкое | Вода, спирт |
| Газообразное | Кислород, азот |
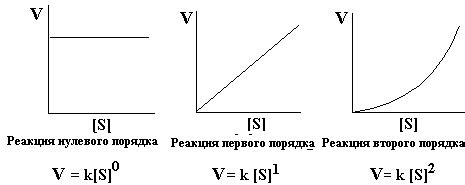
Реакции нулевого, первого и второго порядков и их скорость
Скорость химической реакции описывает, как быстро реагенты превращаются в продукты. Она может зависеть от разных факторов, включая концентрацию реагентов, температуру, поверхность контакта и наличие катализаторов.
Существуют различные типы реакций, которые можно классифицировать по их скорости. Одним из способов классификации является разделение реакций на нулевого, первого и второго порядков в зависимости от изменения концентрации реагентов.
Реакция нулевого порядка характеризуется тем, что скорость реакции не зависит от концентрации реагентов. Это означает, что количество продуктов, образующихся в единицу времени, остается постоянным независимо от концентрации. Примером такой реакции может служить превращение радиоактивного вещества, где время полураспада не зависит от концентрации вещества.
Реакция первого порядка характеризуется тем, что скорость реакции пропорциональна концентрации одного из реагентов. Например, если реакция протекает по уравнению A → продукты, то скорость реакции будет пропорциональна концентрации реагента A. Это означает, что с увеличением концентрации реагента A, скорость реакции также увеличивается.
Реакция второго порядка характеризуется тем, что скорость реакции пропорциональна квадрату концентрации одного из реагентов или произведению концентраций двух реагентов. Например, если реакция протекает по уравнению A + B → продукты, то скорость реакции будет пропорциональна либо квадрату концентрации реагента A, либо произведению концентраций реагентов A и B.
Важно знать порядок реакции и его скорость для контроля и оптимизации процессов. Скорость реакции может быть изменена путем изменения условий, таких как температура и концентрация реагентов, что позволяет контролировать процессы и повысить эффективность.



