Реакции, протекающие в природе и химических процессах, развиваются с различной скоростью. Изучение скорости реакций и факторов, которые на нее влияют, является одной из важнейших задач химии. Одним из таких факторов является температура. Скорость реакции зависит от изменения температуры и может значительно возрастать или понижаться при изменении температурных условий.
Установлено, что при повышении температуры частицы реагентов приобретают большую энергию и, следовательно, высока вероятность их столкновения. Тепловое движение молекул увеличивается с увеличением температуры, и это приводит к увеличению количества эффективных столкновений между реагентами. Таким образом, увеличение температуры приводит к ускорению реакции.
Эта зависимость описывается законом Аррениуса, который установил, что скорость реакции возрастает пропорционально экспоненте от температуры величиной k = Ae^(-Ea/RT), где k - константа скорости реакции, A - пропорциональный коэффициент, Ea - энергия активации, R - газовая постоянная, T - температура в абсолютных единицах.
Исследование зависимости скорости реакции от температуры имеет не только теоретическую, но и практическую значимость. Это позволяет оптимизировать химические процессы, разрабатывать новые способы синтеза веществ и контролировать процессы, происходящие в различных областях науки и техники. Также, изучение реакций и их скоростей при разных температурах позволяет предсказывать и управлять ходом процессов в различных условиях, что является важным фактором в современной промышленности и экологии.
Влияние температуры на скорость реакции

Правило Вант-Гоффа позволяет оценить зависимость скорости реакции от температуры. Согласно этому правилу, скорость реакции увеличивается пропорционально экспоненте отношения активационных энергий при заданных температурах. То есть, с каждым повышением температуры на 10 градусов Цельсия скорость реакции возрастает примерно в два раза.
Интересно, что влияние температуры на скорость реакции может быть как положительным, так и отрицательным. Повышение температуры может ускорить реакцию, но может также привести к ее замедлению или даже полному прекращению, если достигается определенная температура, при которой разрушаются молекулы реагентов.
В реальных условиях лаборатории или промышленности влияние температуры на скорость реакции контролируется с помощью термостатов. Такие устройства позволяют поддерживать постоянную температуру реакционной смеси, обеспечивая стабильность процесса и повышенную производительность.
Однако в повседневной жизни мы также можем обнаружить примеры влияния температуры на скорость реакции. Например, при приготовлении пищи температура влияет на скорость перехода реагентов в продукты. При добавлении горячих специй в блюдо оно становится более ароматным и острее, так как тепло активирует химические реакции, приводящие к освобождению ароматических веществ. Это лишь один из множества примеров, которые демонстрируют влияние температуры на скорость реакции.
Тепловое воздействие на химические реакции
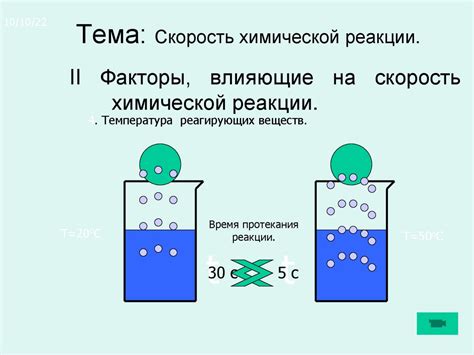
При повышении температуры увеличивается вероятность столкновения молекул с энергией, достаточной для преодоления активационного барьера реакции. Это позволяет молекулам проявлять большую химическую активность и увеличивает количество успешных столкновений.
Тепловое воздействие также может изменять распределение энергии молекул, что влияет на кинетику реакции. Повышение температуры может способствовать более равномерному распределению энергии между молекулами, что увеличивает вероятность эффективного соударения и, следовательно, увеличивает скорость реакции.
Однако необходимо учитывать, что высокая температура может также вызывать разрушение химических связей и деградацию реагентов, что может привести к изменению продуктов реакции или снижению эффективности реакции.
Таким образом, понимание влияния теплового воздействия на химические реакции очень важно при проектировании и оптимизации различных процессов, таких как синтез химических соединений, производство пищевых продуктов и других промышленных процессов.
Закон Аррениуса и его значение

k = A * exp(-Ea/RT)
где:
- k - скоростная константа реакции;
- A - преэкспоненциальный множитель, который зависит от вероятностей частиц с определенными энергиями столкнуться в правильном ориентации;
- Ea - энергия активации реакции;
- R - универсальная газовая постоянная;
- T - абсолютная температура реакции.
Закон Аррениуса имеет огромное значение в химии и физике, так как позволяет предсказывать, как изменится скорость реакции при изменении температуры. Он позволяет определить температурный коэффициент реакции и подтверждает тесную связь между энергией активации и вероятностью прохода реакции.
Закон Аррениуса также находит применение в реальном мире. Например, в химической промышленности он используется для определения оптимальной температуры реакции, что позволяет повысить производительность и эффективность процессов. Кроме того, этот закон помогает понять, как изменения температуры влияют на скорость химических реакций, что является важным для разработки новых материалов и прогнозирования реакций в различных условиях.
Роль активационной энергии в процессе реакции
Роль активационной энергии состоит в том, что она определяет скорость прохождения реакции. Чем выше активационная энергия, тем медленнее протекает процесс. Важно понимать, что активационная энергия зависит от температуры: с повышением температуры активационная энергия снижается, что приводит к увеличению скорости реакции.
Это объясняется тем, что при повышенной температуре молекулы реагирующих веществ обладают большей кинетической энергией и движутся более активно. Это позволяет им преодолеть энергетический барьер активационной энергии и вступить в реакцию с большей вероятностью.
Таким образом, активационная энергия играет важную роль в контроле скорости реакции. Ее понимание и управление позволяет регулировать скорость процессов в химической кинетике и использовать эту информацию для разработки новых реакций и улучшения существующих технологий.
Каталитическое действие температуры на реакцию
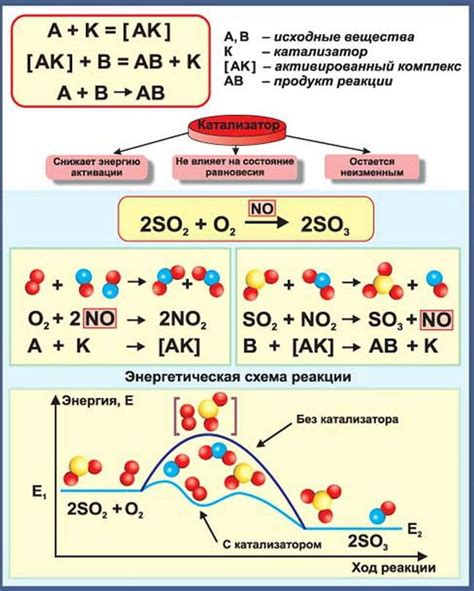
Под каталитическим действием температуры понимается способность повысить активность катализатора в реакции и увеличить скорость образования продуктов за счет изменения условий температуры. Катализаторы являются веществами, которые способны ускорять химическую реакцию, но при этом не участвуют в самой реакции.
Как правило, при повышении температуры увеличивается скорость реакции, так как энергия частиц, составляющих реагенты, увеличивается. Это позволяет преодолеть энергетический барьер реакции и ускорить образование продуктов. Однако, в случае реакций, катализируемых повышением температуры, этот энергетический барьер может быть снижен или проигнорирован, что позволяет реакции протекать быстрее и более эффективно.
Каталитическое действие температуры может проявляться в различных типах реакций. Например, в реакциях окисления многих органических соединений, повышение температуры может увеличить скорость образования продуктов в несколько раз. Также это свойство может применяться для ускорения реакций в промышленных процессах, таких как производство азотной кислоты или аммиака.
Как и в других аспектах скорости реакций, каталитическое действие температуры имеет определенные пределы. При слишком высоких температурах может происходить денатурация катализатора или деградация реагентов, что может снизить скорость реакции. Также существуют реакции, при которых повышение температуры может привести к обратной реакции или снижению скорости образования продуктов.
Зависимость скорости реакции от изменения температуры
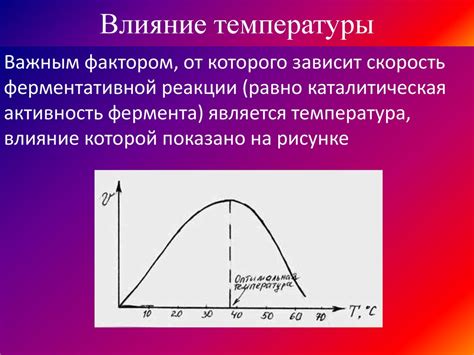
Температура является одним из ключевых параметров, влияющих на скорость химической реакции. В общем случае, при повышении температуры скорость реакции увеличивается, а при понижении – уменьшается.
Это объясняется кинетической теорией: при повышении температуры частицы реагентов получают больше энергии и начинают двигаться быстрее. Это увеличивает вероятность их столкновений, что, в свою очередь, приводит к увеличению количества эффективных столкновений и, следовательно, к увеличению скорости реакции.
Каждая химическая реакция имеет свою активационную энергию – минимальную энергию, которую должны преодолеть реагенты, чтобы превратиться в продукты. Повышение температуры увеличивает энергию частиц, делая преодоление активационной энергии более вероятным. Это приводит к повышению скорости реакции.
Однако, существуют случаи, когда повышение температуры может замедлить реакцию. Это происходит, когда реакция сопровождается обратимым процессом и ее реверсивная реакция при повышении температуры начинает протекать быстрее. В этом случае, при повышении температуры, скорость реакции уменьшается.
Изучение зависимости скорости реакции от изменения температуры является важной задачей в химической кинетике. Эта информация позволяет понять механизмы реакций, оптимизировать процессы и разработать более эффективные катализаторы.
В общем виде, математическое описание зависимости скорости реакции от температуры осуществляется с использованием уравнения Аррениуса:
- ln(k) = ln(A) - Ea/RT
где k – константа скорости реакции, A – преэкспоненциальный множитель, Ea – энергия активации, R – универсальная газовая постоянная, T – температура в кельвинах.
Таким образом, изменение температуры может значительно влиять на скорость реакции, что имеет практическое значение для многих процессов в науке, промышленности и повседневной жизни.