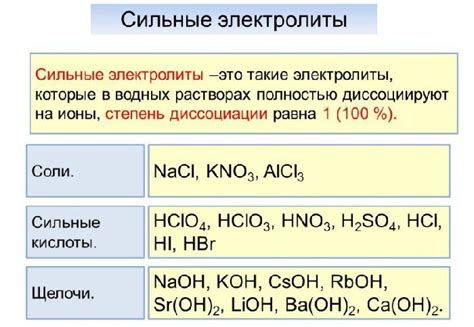
В химии сильным электролитом называют вещество, которое полностью или почти полностью диссоциирует в ионный состав в растворе. Это значит, что сильные электролиты способны разделиться на положительно и отрицательно заряженные ионы в растворе, что делает их хорошими проводниками электрического тока.
Примерами сильных электролитов являются сильные соли, кислоты и щелочи. Среди солей можно выделить хлориды, нитраты, сульфаты и фосфаты металлов. Кислоты с высокой степенью диссоциации также являются сильными электролитами. К ним относятся, например, соляная кислота (HCl), серная кислота (H2SO4) и яблочная кислота (C2H4O2).
Сильные щелочи также обладают высокой степенью диссоциации. К ним относятся гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид бария (Ba(OH)2). Эти вещества способны полностью диссоциировать в ионы натрия (Na+), калия (K+) и гидроксидные ионы (OH-).
Сильные электролиты: понятие и классификация
Сильные электролиты могут быть классифицированы на основе своего химического состава. Они могут быть представлены как неорганическими, так и органическими веществами.
Неорганические сильные электролиты включают в себя различные кислоты, основания и соли. Например, соляная кислота (HCl), серная кислота (H2SO4), аммиак (NH3), калиев гидроксид (KOH) и хлорид натрия (NaCl) являются типичными представителями неорганических сильных электролитов.
Органические сильные электролиты включают растворимые соли органических кислот. Примерами таких соединений являются уксусная кислота (CH3COOH), салициловая кислота (C6H4OHCOOH) и лимонная кислота (C6H8O7).
Сильные электролиты обладают высокой электропроводностью в растворах из-за наличия большого количества свободных ионов. Они широко используются для проведения электролитических реакций, а также в промышленных и бытовых целях.
Что такое электролиты

Ионы - это заряженные частицы, которые возникают при разделении электролита на положительно и отрицательно заряженные части. Эти частицы являются носителями электрического заряда и обеспечивают проводимость электролитов. Важно учитывать, что электролиты могут быть как положительными, так и отрицательными.
Сильные электролиты - это электролиты, которые полностью ионизируются в растворе. Другими словами, они разлагаются на ионы и имеют высокую проводимость электрического тока. Как правило, сильные электролиты включают в себя соли, кислоты и щелочи.
Примеры сильных электролитов включают хлорид натрия (NaCl), серную кислоту (H2SO4) и гидроксид натрия (NaOH).
Важно отметить, что не все электролиты являются сильными. Некоторые электролиты могут быть слабыми, т.е. только частично ионизируются в растворе и имеют более низкую проводимость электрического тока.
Знание о том, что такое электролиты и какие из них являются сильными, является важным для понимания реакций, происходящих в растворах и электролитах в химических процессах.
Чем отличаются сильные электролиты от слабых

Сильные электролиты
Сильные электролиты являются полностью или практически полностью ионизированными в растворе. Ионизация - это процесс расщепления молекулы вещества на ионы под влиянием растворителя. Такие вещества образуют значительное количество ионов в растворе, что делает их хорошими проводниками электрического тока.
Сильные электролиты включают соли, кислоты и щелочи. Примерами сильных электролитов могут служить хлорид натрия (NaCl), серная кислота (H₂SO₄) и гидроксид натрия (NaOH).
Слабые электролиты
Слабые электролиты диссоциируют в растворе только частично, образуя небольшое количество ионов. Это означает, что только некоторая часть вещества превращается в ионы, в то время как большая часть остается в недиссоциированном состоянии. В связи с этим, слабые электролиты имеют низкую проводимость электрического тока.
Слабыми электролитами могут быть некоторые органические кислоты, слабые основания и часть солей. Например, уксусная кислота (CH₃COOH) и аммиак (NH₃) являются примерами слабых электролитов.
Основные отличия
Главное отличие между сильными и слабыми электролитами заключается в степени диссоциации. Сильные электролиты полностью или практически полностью диссоциируют, образуя большое количество ионов. Слабые электролиты диссоциируют только частично, образуя небольшое количество ионов.
Также, проводимость электрического тока в растворе сильного электролита будет выше, чем в растворе слабого электролита, из-за большего количества ионов. Слабые электролиты имеют низкую электропроводность.
Сильные электролиты и слабые электролиты имеют разную степень диссоциации и проводимости электрического тока в растворе, что делает их важными концепциями в химии и коллоидной химии.
Основные свойства сильных электролитов

- Ионизация: Сильные электролиты полностью ионизируются в растворе, что означает, что они разделяются на положительные и отрицательные ионы. Это делает их способными проводить электрический ток и делает их электрически активными.
- Высокая проводимость: Благодаря полной ионизации, сильные электролиты обладают высокой электропроводностью. Это означает, что они хорошо проводят электрический ток и могут быть использованы в различных электрических устройствах и схемах.
- Растворимость: Сильные электролиты обычно хорошо растворяются в воде и других растворителях. Это позволяет им легко переходить в ионное состояние и давать растворы, которые легко проводят электрический ток.
- Электролитическая диссоциация: Когда сильный электролит растворяется в воде, он проходит процесс электролитической диссоциации, при котором молекулы разлагаются на ионы. Это явление подтверждает их способность быть эффективными проводниками электрического тока.
- Формула по нотации: Описание сильных электролитов обычно включает в себя заполнение квадратных скобок вокруг формулы вещества, чтобы указать его способность ионизироваться. Например, NaCl, KNO3, HCl, и т.д.
- Реактивность: Сильные электролиты имеют высокую реакционную способность из-за наличия свободных ионов. Они могут с легкостью участвовать в различных химических реакциях и играть важную роль в жизнедеятельности организмов.
Изучение основных свойств сильных электролитов позволяет понять их важность в химических процессах и их широкое применение в различных областях науки и технологии.
Примеры сильных электролитов
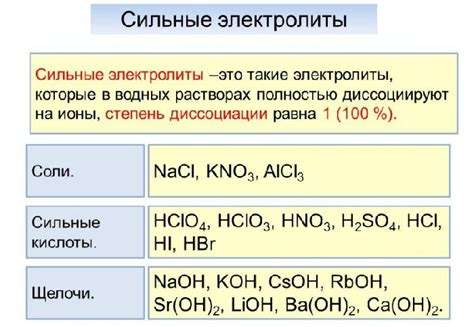
| Вещество | Формула |
|---|---|
| Соляная кислота | HCl |
| Серная кислота | H₂SO₄ |
| Натриевая гидроксид | NaOH |
| Калиевая селитра | KNO₃ |
| Хлорид аммония | NH₄Cl |
Эти вещества обладают высокой степенью ионизации в растворе и способны проводить электрический ток. Они широко используются в химической промышленности и лабораториях.
Как сильные электролиты взаимодействуют с водой
Сильные электролиты представляют собой вещества, которые при растворении в воде полностью диссоциируются на положительно и отрицательно заряженные ионы. Взаимодействие сильных электролитов с водой происходит следующим образом:
- Когда сильный электролит попадает в воду, между его молекулами и молекулами воды происходят электростатические взаимодействия.
- Полярные молекулы воды (H2O) положительно заряжены на атоме водорода и отрицательно заряжены на атоме кислорода.
- Когда сильный электролит растворяется в воде, его ионы перенимают заряды от воды, образуя гидратирующую оболочку вокруг себя.
- Гидратированные ионы образуют ионные соединения с молекулами воды, увеличивая общее количество растворенных частиц в воде и создавая электролитическую проводимость.
- При взаимодействии сильного электролита с водой происходит образование гидроксид-ионов, гидрониевых ионов и других ионных соединений.
- Это взаимодействие приводит к электролитическому разложению воды и образованию электрического тока.
Таким образом, сильные электролиты взаимодействуют с водой, образуя гидратированные ионы и ионные соединения, что делает их хорошими проводниками электричества и позволяет им обладать сильной электролитической проводимостью.
Использование сильных электролитов в химических процессах
Одним из основных применений сильных электролитов является их использование в электролизе. Электролиз - это процесс, при котором с помощью электрического тока происходят химические реакции, направленные на разложение веществ на ионы. Сильные электролиты могут быть использованы в качестве электролитов, то есть веществ, которые обеспечивают проводимость тока в электролитической ячейке. Таким образом, они помогают ускорить процесс разложения вещества и увеличить его эффективность.
Сильные электролиты также широко применяются в аналитической химии. Они использоваться в качестве стандартов для определения концентрации ионов в растворах, а также в качестве калибровочных растворов для измерения pH. Благодаря своей полной ионизации, они позволяют точно контролировать концентрацию ионов и обеспечивают точные результаты анализов.
Необходимо отметить, что использование сильных электролитов также может иметь некоторые негативные последствия. Например, они могут быть коррозионно-активными и вызывать повреждение материалов, с которыми контактируют. Поэтому важно правильно выбирать сильные электролиты для конкретных процессов и принимать меры по защите оборудования от коррозии.
Основными примерами сильных электролитов являются соли, кислоты и щелочи. Соли образуются в результате реакции между кислотами и основаниями, при этом происходит образование ионов, которые обладают зарядом. Кислоты и щелочи, в свою очередь, являются сильными электролитами, так как они ионизируются в растворе и образуют ионы.
Сильные электролиты широко используются в химической промышленности и лабораторной практике. Главное их применение связано с возможностью изменять химические реакции в растворе, контролировать pH среды и проводить электролиз. Также они играют важную роль в биологических системах, управляя химическими процессами в организме.
Умение определить сильные электролиты и понимать их свойства очень важно для понимания химических процессов и их приложений в различных областях науки и техники.



