Строение вещества – это одна из ключевых тем в изучении физики в седьмом классе. Понимание строения вещества поможет ученикам разобраться во многих явлениях и процессах, которые окружают нас в повседневной жизни. Эта тема замечательно дополняет знания учащихся о физических явлениях и позволяет им углубить свое понимание физических законов и принципов.
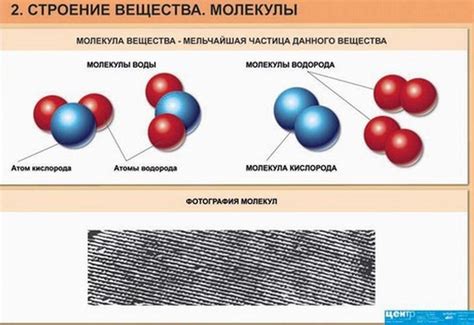
Во время изучения строения вещества в физике 7 класса обычно рассматриваются основные составляющие вещества – атомы, молекулы и ионы. Атомы, как известно, являются основными строительными блоками вещества. Они обладают положительно заряженным ядром и отрицательно заряженными электронами, движущимися вокруг ядра. Молекулы состоят из двух или более атомов, которые могут быть одного или разных элементов. Ионы – это атомы или группы атомов, у которых имеются недостающие или лишние электроны.
Важно отметить, что расположение и связи между атомами, молекулами и ионами влияют на свойства вещества. Например, молекулы сильно связанных атомов создают кристаллическую решетку, что делает вещество твердым. В то же время, молекулы слабо связанных атомов могут двигаться относительно друг друга, что приводит к состоянию вещества, известному как жидкость. Ионные связи между атомами приводят к образованию ионной решетки и обеспечивают особые свойства, характерные для солей.
Понятие вещества
Вещество может существовать в трех состояниях: твердом, жидком и газообразном. Твердые вещества имеют определенную форму и объем, жидкости - определенный объем, но неопределенную форму, газы - неопределенную форму и объем.
Вещество состоит из атомов и молекул, которые соединяются между собой различными способами, образуя разные вещества. Атомы - это наименьшие частицы вещества, которые сохраняют его химические свойства. Молекулы - это связанные атомы.
Физические свойства вещества - это свойства, которые можно измерить или наблюдать без изменения химического состава вещества. К ним относятся плотность, температура плавления, температура кипения, теплопроводность и другие.
Химические свойства вещества - это свойства, которые проявляются в процессе химических реакций, при которых вещество превращается в другие вещества.
Классификация веществ
Вещества могут быть классифицированы по различным признакам. Рассмотрим основные классификации:
- По агрегатному состоянию:
- Твердые вещества - имеют определенную форму и объем, частицы плотно упакованы и почти не двигаются;
- Жидкие вещества - не имеют определенной формы, но имеют объем, частицы могут свободно двигаться;
- Газообразные вещества - не имеют определенной формы и объема, частицы свободно двигаются и разделяются.
- По химическому составу:
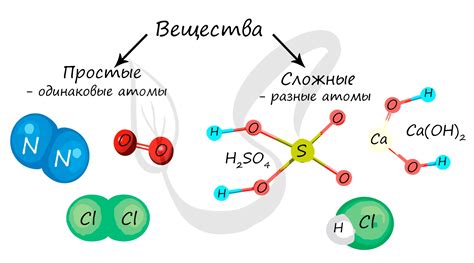
- Простые вещества - состоят из одного вида атомов или молекул;
- Сложные вещества - состоят из нескольких разных видов атомов или молекул.
- По происхождению:
- Натуральные вещества - существуют в природе без человеческого вмешательства;
- Искусственные вещества - созданы или изменены человеком;
- Синтетические вещества - полностью созданы человеком из других веществ.
Классификация веществ позволяет более точно изучать свойства и поведение различных видов веществ, а также прогнозировать их реакции и применение в различных областях жизни.
Строение атома
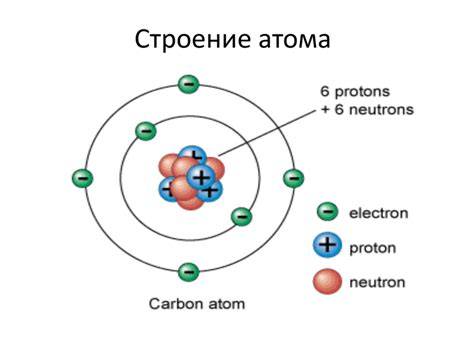
Электроны - это негативно заряженные частицы, которые обращаются вокруг ядра атома по определенным орбитам или энергетическим уровням. Количество электронов в атоме определяет его химические свойства и положение в таблице химических элементов.
Протоны - это положительно заряженные частицы, которые находятся в ядре атома. Они определяют атомный номер элемента и обуславливают его положение в таблице химических элементов. Количество протонов в ядре атома определяет его химический элемент.
Нейтроны - это нейтральные по заряду частицы, которые также находятся в ядре атома. Они вместе с протонами образуют ядро атома. Количество нейтронов в атоме может варьироваться, создавая изотопы одного и того же химического элемента.
Строение атома можно представить в виде следующей таблицы:
| Частица | Символ | Масса, а.е.м. | Заряд |
|---|---|---|---|
| Электрон | e- | очень маленькая | -1 |
| Протон | p+ | 1 | +1 |
| Нейтрон | n | 1 | 0 |
Валентность атома
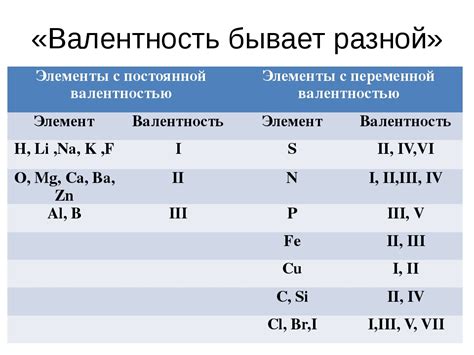
Валентность атома вещества влияет на его химические свойства и способность образовывать соединения. Часто валентность атома обозначается числом или символом, например, Na+ или Cl-. Положительная валентность указывает на потерю электронов, а отрицательная - на их приобретение.
Валентность атома определяет количество электронов, которые атом может отдать или принять при образовании химических связей. Например, атом натрия (Na) имеет один электрон на внешнем уровне, поэтому его валентность равна 1. Атом хлора (Cl) имеет семь электронов на внешнем уровне, поэтому его валентность равна -1.
Валентность атомов определяет тип связи, которую они могут образовывать. Атомы с положительной валентностью образуют ионные соединения, в которых они отдают свои электроны атомам с отрицательной валентностью. Атомы с одинаковой валентностью могут образовывать ковалентные связи, в которых они обменивают электроны с другими атомами.
| Атом | Валентность |
|---|---|
| Натрий (Na) | +1 |
| Хлор (Cl) | -1 |
Знание валентностей атомов помогает определить строение и характер связей в химических соединениях. Изучение валентности атомов является основой для понимания реакций и превращений веществ, а также разработки новых материалов и лекарственных средств.
Молекулярное строение веществ
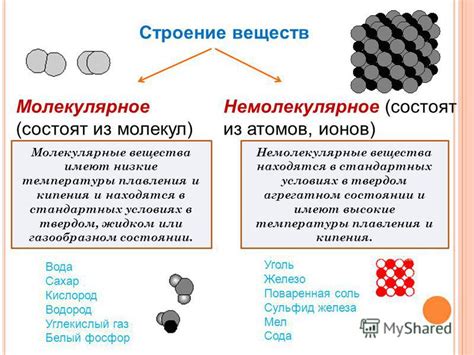
Молекулярное строение вещества непосредственно связано с расположением и взаимодействием атомов в пространстве. Атомы объединяются в молекулы с помощью химических связей. Молекулы, в свою очередь, могут образовывать различные структуры и обладать разными свойствами.
Молекулы могут быть простыми или сложными. Простые молекулы состоят из одного типа атомов, например, молекулы кислорода (O2) или азота (N2). Сложные молекулы состоят из двух или более разных типов атомов, например, молекула воды (H2O) или углекислого газа (CO2).
Молекулярное строение влияет на физические и химические свойства вещества. Например, молекулы сильно связанных атомов могут образовывать кристаллическую структуру, что делает вещество твердым. Молекулы со слабыми связями могут перемещаться относительно друг друга, что делает вещество жидким или газообразным.
Изучение молекулярного строения вещества позволяет понять, как оно взаимодействует с другими веществами и какие изменения может претерпеть в различных условиях. Это знание является ключевым для понимания мира вокруг нас и применения его в различных областях, включая химию, биологию, фармацевтику, материаловедение и многое другое.
Решение задач по строению вещества

Для решения задач по строению вещества необходимо усвоить основные понятия и законы физики.
1. Задачи о массе и объеме:
- Для решения задач, связанных с массой и объемом вещества, необходимо знать формулу для вычисления плотности (плотность = масса / объем).
- При решении задач указывайте значения массы и объема, искомую величину и известные данные. При необходимости применяйте соответствующие формулы и делайте необходимые вычисления.
- Не забывайте указывать единицы измерения при записи ответов.
2. Задачи о взаимодействии веществ:
- Для решения задач по взаимодействию веществ необходимо знать основные типы взаимодействия: гравитационное, электростатическое и силы упругости.
- Умение составлять уравнения для силы взаимодействия между двумя телами (сила = коэффициент взаимодействия × площадь контакта).
- Необходимо знать формулу для вычисления работы (работа = сила × путь).
3. Задачи о тепловых явлениях:
- Для решения задач, связанных с тепловыми явлениями, необходимо знать законы сохранения энергии.
- Умение применять формулу для вычисления количества теплоты (Q = mcΔT), где m - масса вещества, c - удельная теплоемкость, ΔT - изменение температуры.
- Необходимо уметь применять формулу для вычисления механической работы (работа = сила × путь).
При решении задач необходимо внимательно анализировать условия задачи, правильно формулировать исходные данные, использовать соответствующие физические законы и формулы, делать необходимые вычисления и давать ответы с указанием единиц измерения.



