В химической науке, взаимодействие различных веществ зачастую приводит к возникновению новых веществ. Одним из интересных примеров является взаимодействие соединений бария, таких как Ba(NO3)2, с сульфатами, среди которых присутствует Na2SO4. Это реакция, которая может породить новые вещества и вызвать интерес у химиков и исследователей.
При взаимодействии Ba(NO3)2 и Na2SO4 происходит ионный обмен. В результате этой реакции образуется несколько новых веществ, одним из которых является барийсульфат (BaSO4). Барийсульфат имеет химическую формулу BaSO4 и является белым кристаллическим веществом, которое плохо растворимо в воде.
Образование барийсульфата (BaSO4) при взаимодействии Ba(NO3)2 и Na2SO4 можно объяснить реакцией между ионами. В результате реакции ионы бария (Ba2+) и ионы сульфата (SO42-) соединяются и образуют барийсульфат (BaSO4), который выделяется в виде осадка.
Образование хлорида бария

При взаимодействии бария (Ba) с хлоридом натрия (NaCl) образуется осадок хлорида бария (BaCl2). Это реакция двойного обмена, при которой ионы бария (Ba2+) и ионы хлора (Cl-) обмениваются местами:
| Исходные реагенты | Реакционная схема | Образовавшийся продукт |
|---|---|---|
| Барий нитрат (Ba(NO3)2) | ||
| Натриевый сульфат (Na2SO4) | Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3 | BaSO4 |
Хлорид бария (BaCl2) представляет собой белый кристаллический порошок, растворимый в воде. Он обладает высокой плотностью и используется в различных индустриальных процессах и аналитических методах.
Химическая реакция между Ba(NO3)2 и Na2SO4

При взаимодействии растворов Ba(NO3)2 (нитрат бария) и Na2SO4 (сульфат натрия) происходит химическая реакция, в результате которой образуется несколько веществ.
В начальных растворах присутствуют ионы Ba2+, NO3-, Na+ и SO42-. При смешивании растворов происходит две основные реакции:
1. Барий Ba2+ реагирует с сульфатом SO42- и образует осадок бария (BaSO4).
2. Ионы натрия Na+ и нитратные ионы NO3- не реагируют между собой, остаются в растворе и не образуют новых соединений.
Таким образом, в результате химической реакции между Ba(NO3)2 и Na2SO4 образуется осадок бария (BaSO4), который выпадает из раствора, а также остаются ионы натрия (Na+) и нитратные ионы (NO3-) в растворе.
Образование осадка бария (BaSO4) может служить методом для определения наличия и концентрации ионов бария в растворе. Осадок бария обладает высокой плотностью, поэтому может быть легко выделен и идентифицирован.
Особенности реакции

При взаимодействии растворов солей Ba(NO3)2 и Na2SO4 возникает реакция двойного обмена, в результате которой образуется осадок бария сульфата (BaSO4).
Особенностью этой реакции является высокая степень несовместимости растворов бария и сульфата. Барий сульфат обладает низкой растворимостью в воде, поэтому при взаимодействии растворов Ba(NO3)2 и Na2SO4 находится в осадке в виде белого твердого вещества.
Эта реакция может быть использована для качественного определения бария в различных образцах, так как осадок бария сульфата является хорошим индикатором наличия бария в растворе.
Осадок бария сульфата образуется в соответствии с уравнением реакции:
Ba(NO3)2 + Na2SO4 -> BaSO4 + 2NaNO3
Физические свойства хлорида бария
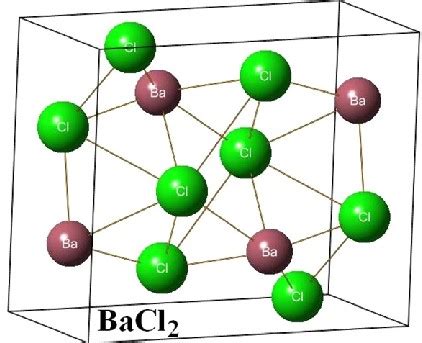
Хлорид бария имеет хорошую растворимость в воде, образуя бесцветные растворы. Эти растворы обладают некоторыми особенностями и могут быть использованы в различных областях.
Физические свойства хлорида бария:
- Молекулярная масса: 208,23 г/моль
- Температура плавления: 962 °C
- Плотность: 3,856 г/см³
- Растворимость: 27,5 г/100 мл воды (при 20 °C)
Хлорид бария широко используется в различных отраслях, включая химическую промышленность, медицину, стекольную промышленность и другие. В частности, он может быть использован для производства бария, катализаторов, электродов и других веществ.
Однако, необходимо помнить, что хлорид бария является токсичным веществом. При работе с ним следует соблюдать необходимые меры предосторожности и работать в хорошо проветриваемом помещении.
Применение хлорида бария

- Аналитическая химия: Хлорид бария используется в качестве реактива для определения наличия сульфатов и фосфатов в анализируемых образцах. Барий-сульфат, образующийся при реакции, является нерастворимым в воде и может быть выделен в виде осадка. Это позволяет определить концентрацию соответствующих соединений.
- Медицина: Хлорид бария используется в радиологии в качестве контрастного вещества при рентгенологических исследованиях пищевода, желудка и кишечника. Внутрь принимаемый барий создает ярко видимую ламинацию, что позволяет получить детальные изображения внутренних органов.
- Производство огнетушителей: Хлорид бария используется в составе порошковых огнетушителей. При попадании на пламя, данный материал образует нерастворимый барий карбонат или барий оксид. Эти соединения препятствуют реакции окисления, обуздывая огонь.
- Производство стекла: Хлорид бария добавляют в процессе производства стекла для повышения его прозрачности и светопропускания. Это особенно важно в оптике, при создании линз и приборов для измерения и фокусировки света.
- Производство пигментов: Хлорид бария широко используется при изготовлении пигментов для красок. Бариевые пигменты обладают высокой стойкостью к свету и хорошей укрывистостью, что делает их популярными в промышленности.
Внимание! Хлорид бария является ядовитым веществом. При работе с ним необходимо соблюдать меры безопасности и носить защитные средства.
Безопасность и меры предосторожности

- При взаимодействии Ba(NO3)2 и Na2SO4 может образоваться твердое вещество BaSO4, которое считается нетоксичным. Однако, необходимо соблюдать некоторые меры предосторожности при работе с этими веществами.
- Перед началом экспериментов следует надеть защитные очки, резиновые перчатки и фартук, чтобы предотвратить контакт с кожей, глазами и одеждой.
- Всю работу необходимо проводить в хорошо проветриваемом помещении или под вытяжкой, чтобы избежать вдыхания паров и пыли веществ.
- При взаимодействии Ba(NO3)2 и Na2SO4 может наблюдаться выделение тепла, поэтому необходимо избегать возможности возникновения ожогов и держать вещества подальше от источников огня.
- Если вещество попадает на кожу или в глаза, немедленно промыть область обильным количеством воды и обратиться за медицинской помощью.
- После работы все контейнеры и оборудование следует тщательно промыть водой и сохранять в безопасном месте.



