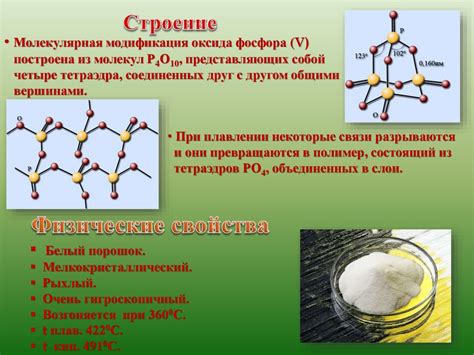
Оксид фосфора 5, также известный как фосфорная пентоксид, является неорганическим соединением, состоящим из одной молекулы фосфора и пяти молекул кислорода. Этот соединитель имеет формулу P2O5 и представляет собой бесцветные кристаллы или белый порошок с высоким температурным плавлением.
Оксид фосфора 5 является сильным окислителем и реагирует с различными веществами. Он обладает высокими кислотными свойствами и может реагировать с щелочами, образуя соли. Также, он может реагировать с металлами, аммиаком, карбонатами и многими другими веществами.
Разнообразие реакций, в которых участвует оксид фосфора 5, делает его важным компонентом в химической промышленности. Он используется для производства фосфорных кислот, удобрений, пластических масс, пропеллеров и других продуктов.
Оксид фосфора 5: основные свойства и применение
Оксид фосфора 5 обладает следующими свойствами:
- Кислотность: Оксид фосфора 5 является очень кислым соединением. При взаимодействии с водой образует ортофосфорную кислоту.
- Реактивность: Дифосфорная пятиокись реагирует со многими веществами, в том числе с основаниями, оксидами, солями и металлами, образуя различные продукты реакций.
- Высокая температура плавления: Точка плавления оксида фосфора 5 составляет около 340 градусов Цельсия.
Применение оксида фосфора 5:
- Производство удобрений: Дифосфорная пятиокись широко используется в производстве фосфорных удобрений, таких как суперфосфаты, тройные суперфосфаты и др. Эти удобрения содержат фосфорные соединения, которые необходимы для роста растений.
- Производство стекла: Оксид фосфора 5 используется в производстве стекла и стеклянных изделий, чтобы улучшить их свойства и химическую стойкость.
- В производстве органических соединений: Оксид фосфора 5 является важным компонентом в химической промышленности для синтеза органических соединений, таких как полиэфиры, полиимиды и др.
- Катализатор: Дифосфорная пятиокись используется в качестве катализатора в различных химических реакциях.
Оксид фосфора 5 является важным соединением в химической промышленности и играет существенную роль в различных сферах, начиная от земледелия и производства стекла, и заканчивая производством органических соединений.
Взаимодействие оксида фосфора 5 с другими веществами:

Оксид фосфора 5, также известный как оксид фосфора(V), обладает высокой химической активностью и реагирует с различными веществами. Вот некоторые важные реакции, в которых участвует данное соединение:
1. Реакция с водой: оксид фосфора 5 образует с водой фосфорную кислоту. Данная реакция сопровождается выделением тепла. Уравнение реакции: P4O10 + 6H2O → 4H3PO4
2. Реакция с гидроксидами: оксид фосфора 5 взаимодействует с гидроксидами металлов, образуя соли. Уравнение реакции: P4O10 + 8NaOH → 4Na2HPO4 + 4H2O
3. Реакция с кислотами: оксид фосфора 5 общается с кислотами, образуя фосфатные соли и воду. Уравнение реакции: P4O10 + 12HCl → 4H3PO4 + 6H2O
4. Реакция с щелочами: оксид фосфора 5 реагирует с щелочами, образуя соли и воду. Уравнение реакции: P4O10 + 12KOH → 4K3PO4 + 6H2O
5. Реакция с аммиаком: оксид фосфора 5 взаимодействует с аммиаком, образуя соединение аммоний дифосфат. Уравнение реакции: P4O10 + 16NH3 → 4(NH4)2HPO4
6. Реакция с металлами: оксид фосфора 5 реагирует с некоторыми металлами, образуя соединения металлических фосфатов. Уравнение реакции: P4O10 + 20Mg → 4Mg3(PO4)2
Взаимодействие оксида фосфора 5 с другими веществами расширяет его применение в различных процессах и синтезе химических соединений.
Реакции с водой, кислородом и кислотами:

Оксид фосфора 5 взаимодействует с водой, образуя фосфорную кислоту:
| Реакция | Уравнение реакции |
|---|---|
| Реакция с водой | P4O10 + 6H2O → 4H3PO4 |
Оксид фосфора 5 также реагирует с кислородом, образуя пентоксид фосфора:
| Реакция | Уравнение реакции |
|---|---|
| Реакция с кислородом | P4O10 + 5O2 → 2P2O5 |
Реакция оксида фосфора 5 с различными кислотами может привести к образованию различных солей. Ниже приведены некоторые примеры реакций:
| Реакция | Уравнение реакции |
|---|---|
| Реакция с серной кислотой | P4O10 + 6H2SO4 → 4H3PO4 + 6SO2 |
| Реакция с соляной кислотой | P4O10 + 8HCl → 4H3PO4 + 4POCl3 |
| Реакция с азотной (азотной пятерочной) кислотой | P4O10 + 12HNO3 → 4H3PO4 + 6N2O5 + 3H2O |
| Реакция с уксусной кислотой | P4O10 + 12CH3COOH → 4(CH3COO)3PO + 6H2O |
Список реакций с основными группами веществ:
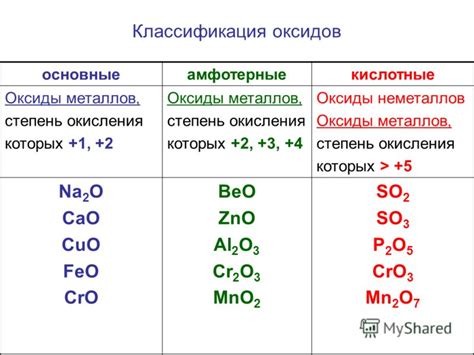
- С реакцией с кислотами образует соли (фосфаты) и воду.
- Со щелочами образует гидроксиды и воду.
- С аммиаком образует аммониевые соединения.
- С ангидридами образует кислоты.
- С водой образует фосфорную кислоту.
- С металлами образует соли (фосфиды).
- Со спиртами образует эфиры.
- С органическими кислотами образует эфиры.



