Химические связи играют ключевую роль в определении структур и свойств молекул. Знание о том, как формируются связи между атомами, позволяет понять множество физико-химических процессов.
В химии существует два основных типа химических связей: сигма (σ) и пи (π) связи. Они различаются по способу образования и характеру взаимодействия электронов атомов.
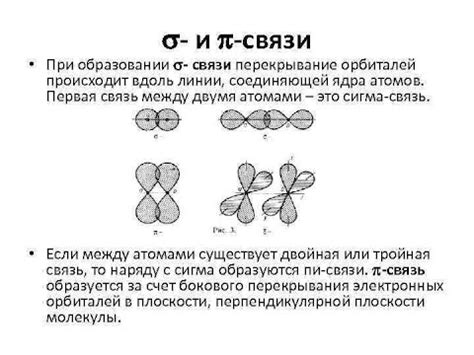
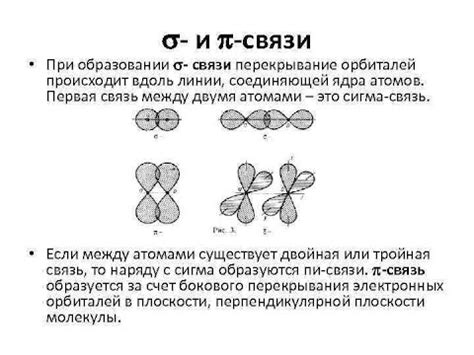
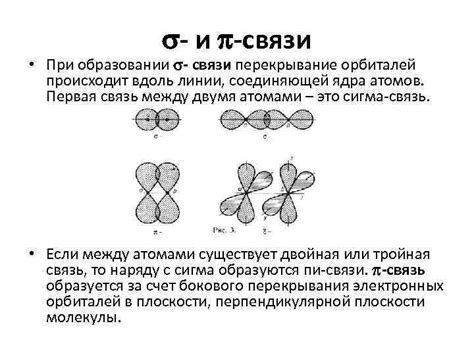
Сигма связи образуются посредством перекрытия s- и p-орбиталей атомов в молекуле. Перекрывающиеся орбитали обеспечивают сильное взаимодействие электронов вдоль оси связи между атомами. Сигма связь характеризуется высокой симметрией и сильным взаимодействием электронов, что делает её очень прочной и стабильной.
Пи связи возникают при перекрытии п-орбиталей атомов, располагающихся параллельно друг другу. Электроны в пи-связях располагаются симметрично относительно оси связи и слабо взаимодействуют между собой. Поэтому пи-связи обычно более слабые и менее устойчивые, чем сигма-связи. Однако они играют важную роль в определении конформации молекул и их химических свойств.
Что такое сигма и пи связи?
Сигма связь - это тип связи, в которой электронная плотность между двумя атомами распределена симметрично относительно оси связи. Такая связь формируется, когда два атома соединяются прямым наложением своих орбиталей.
Пи связь - это тип связи, которая формируется при наложении пи-орбиталей двух атомов, перпендикулярно оси связи. В пи-связи электронная плотность сосредоточена в области, называемой облаком пи-электронов.
Главное отличие между сигма и пи связями заключается в том, как распределена электронная плотность в области связи. Сигма связь обладает большей энергией и является более прочной и устойчивой, чем пи связь. Кроме того, сигма связь может быть образована лишь одной парой орбиталей между двумя атомами, в то время как пи связь требует двух пар орбиталей.
Таким образом, сигма и пи связи играют ключевую роль в формировании структуры и свойств химических соединений, а их особенности определяют их реакционную способность и химическую активность.
Значение сигма и пи связей в химии
В химии связи между атомами могут быть различными по своей природе и свойствам. Среди них особое место занимают сигма и пи связи.
Сигма (σ) связь представляет собой прямую связь между атомами, в которой электроны образуют пару, находящуюся между ядрами. Она является самой простой и наиболее распространенной формой связи в органической и неорганической химии. Сигма связь обладает высокой энергией и стабильностью.
Пи (π) связь представляет собой более сложную форму связи, в которой электроны образуют не пару, а два облака электронной плотности, располагающиеся над и под плоскостью ядер связанных атомов. Пи связь является более слабой и менее стабильной, чем сигма связь, и может образовываться только между атомами, имеющими свободные p-орбитали.
Сигма связи характеризуются высокой зоной электронной плотности между ядрами и обеспечивают прочное соединение атомов в молекулах. Они обладают высокой энергией и способны участвовать в различных химических реакциях.
Пи связи, в свою очередь, играют важную роль в образовании двойных и тройных связей, а также в конъюгированных системах. Они обладают более слабой энергией, чем сигма связи, и могут быть представлены в виде облаков электронной плотности над и под плоскостью молекулы.
Таким образом, сигма и пи связи играют важную роль в формировании молекул и определяют их структуру, свойства и реакционную способность. Понимание этих связей позволяет более глубоко изучать и понимать химические процессы и взаимодействия молекул.
Сравнение сигма и пи связей
- Сигма связи: Сигма связь является самой простой и наиболее распространенной связью. Она формируется между атомами, когда их электронные облака перекрываются. Сигма связи отличаются высокой стабильностью и прочностью, что делает их наиболее устойчивыми. Они образуются с помощью гибридизации орбиталей атомов и могут быть одиночными или множественными.
- Пи связи: Пи связи формируются между атомами, когда электронные облака параллельных орбиталей перекрываются. Они обычно возникают между атомами, имеющими двойные или тройные связи. Пи связи менее стабильны и слабы, чем сигма связи. Они могут быть образованы только после образования сигма связи.
Различия между сигма и пи связями:
- Сигма связи образуются первыми при образовании химической связи, а пи связи - вторыми.
- Сигма связи обладают большей стабильностью и прочностью по сравнению с пи связями.
- Сигма связи симметричны, тогда как пи связи асимметричны.
- Сигма связи могут быть одиночными, двойными или тройными, в то время как пи связи могут быть только двойными или тройными.
Изучение сигма и пи связей является важным аспектом органической химии, так как они определяют химические свойства и реакционную способность органических соединений.
Отличия между сигма и пи связями
Сигма связь является самой прямой и сильной формой связи, образуяся между двумя атомами, когда их орбитали перекрываются непосредственно вдоль оси соединения. Она обладает сферической симметрией, и все электроны, участвующие в связи, находятся между ядрами двух атомов.
Пи связь, к сравнению с сигма связью, является слабой связью, образующейся параллельно соединяющей оси между двумя атомами. Она возникает из перекрытия пи-орбиталей, которые располагаются над и под плоскостью атомных ядер.
Одним из ключевых отличий между сигма и пи связями является их энергия. Сигма связи обладают большей энергией и являются более прочными, в то время как пи связи слабее и более подвержены разрыву. Это объясняет, почему в молекулах, образованных только сигма связями, энергия связи всегда больше, чем в молекулах, содержащих пи связи.
Также следует отметить, что сигма связи могут образовываться между атомами разного вида, тогда как пи связи образуются только между орбиталями одного типа, таких как p-орбитали.
Важно отметить, что сигма и пи связи часто взаимодействуют друг с другом и вместе образуют множество разнообразных молекул. Это сочетание типов связей позволяет обеспечить разнообразие структур и свойств в химических соединениях.
Как образуются сигма и пи связи?
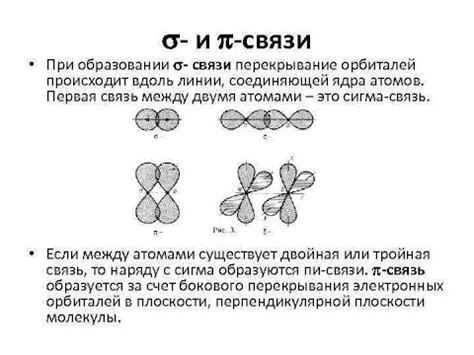
Сигма и пи связи представляют собой различные типы химических связей между атомами. Эти связи образуются в результате перекрытия орбиталей атомов, что приводит к образованию молекулы.
Сигма (σ) связь образуется, когда две орбитали атомов перекрываются по оси, проходящей через ядро обоих атомов. Такое перекрытие позволяет электронам образовать область с наибольшей вероятностью находиться между ядрами атомов. Сигма связь является наиболее прочной из всех типов химических связей.
В отличие от сигма связи, пи (π) связь образуется при перекрытии двух параллельных плоскостей орбиталей атомов. Перекрывающиеся орбитали находятся над и под плоскостью, проходящей через ядра атомов. Пи-связи состоят из двух компонент - связи π-п и связи π-σ.
В зависимости от типа взаимодействия орбиталей их геометрии, образуются различные типы сигма и пи связей. Сигма связи образуются, когда взаимодействуют s, sp, sp2 и sp3 гибридизованные орбитали. Пи связи образуются при взаимодействии p и d орбиталей.
Образование сигма и пи связей играет важную роль в химических реакциях и определяет свойства молекул и соединений. Понимание этих типов связей помогает понять химические свойства и реакционную способность вещества.
Формирование сигма связей

Процесс формирования сигма связей начинается с объединения атомных орбиталей в зоне перекрытия. Это может происходить между s-орбиталями, p-орбиталями или между s-орбиталью атома и p-орбиталью соседнего атома. Перекрытие орбиталей создает область пространственного наложения, в которой образуется сигма связь.
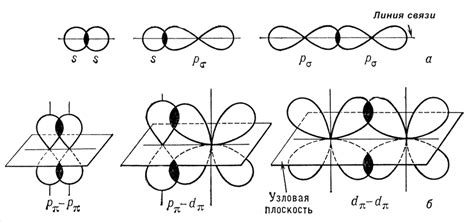
Сигма связь представляет собой пять типов орбиталей: s-s, s-p, p-p, s-d и p-d. Каждый тип связи зависит от типа орбиталей, которые перекрываются. Например, в случае s-p связи, s-орбиталь одного атома перекрывается с p-орбиталью другого атома.
| Тип связи | Орбитали атомов |
|---|---|
| s-s | два s-орбиталя |
| s-p | s-орбиталь и p-орбиталь |
| p-p | два p-орбиталя |
| s-d | s-орбиталь и d-орбиталь |
| p-d | p-орбиталь и d-орбиталь |
Формирование сигма связи является важным шагом в образовании молекул и определяет их структуру и свойства. Сигма связи обладают высокой энергией и устойчивостью, что позволяет им существовать в твердом, жидком и газообразном состоянии.
Процесс образования сигма связей
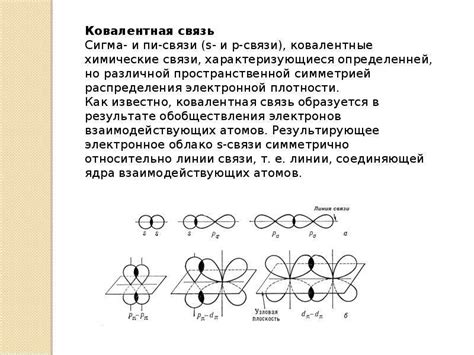
Образование сигма связи начинается с перекрытия электронных облаков этих орбиталей. Орбитали сходятся между собой по осям связь, что и придаёт сигма-связи форму. На этом этапе, электронные облака орбиталей сцепляются и начинают образовывать область наибольшей плотности электронов между атомами.
Сигма связи также могут формироваться между атомами разного вида, например, между атомом углерода и атомом кислорода в органических молекулах. В таких случаях электронные облака орбиталей образуются путём наложения электронов одной орбитали вакантной орбитали другой.
После образования сигма связи, они могут быть усилены или ослаблены эффектами соседних атомов или групп. Например, электродонорная или электроакцепторная группы смежных атомов могут изменить электронную плотность в сигма-связи, что приведёт к изменению её длины и прочности.
Примеры сигма связей в химии
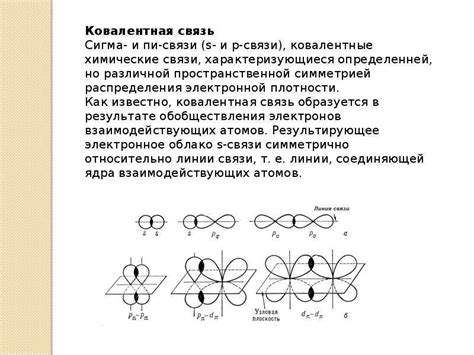
Примером сигма связи может служить связь между атомами водорода в молекуле H2. В этом случае два атома водорода делятся электронной парой, образуя симметричную сигма связь. Другие примеры сигма связей включают связь Карбон-Карбон в молекуле метана (CH4) и связи Кислород-Водород в молекуле воды (H2O).
Сигма связи также могут образовываться между атомами различных элементов, например, между атомов углерода и азота в молекуле аммиака (NH3). В этом случае сигма связь образуется между азотным атомом и одним из водородных атомов, а также между углеродным атомом и азотным атомом.
Сигма связи играют важную роль в определении структуры и свойств химических соединений. Они определяют длину и углы связей, а также влияют на реакционную способность молекулы. Понимание характеристик и образования сигма связей позволяет углубить знания о строении веществ и их химическом поведении.
Формирование пи связей
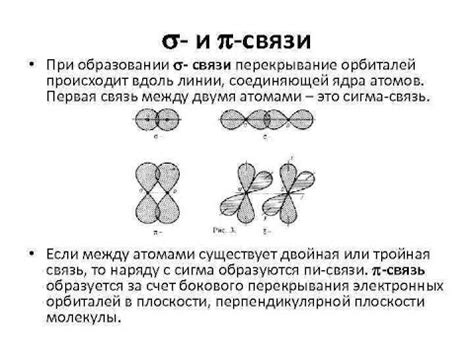
Формирование пи связей происходит в результате общего использования двух электронов двух атомов. При формировании пи связи участвуют p-орбитали, которые расположены перпендикулярно к плоскости молекулы. Эти орбитали формируют электронное облако, которое и создает стабильность в молекуле.
Пи связи могут возникать между атомами углерода, азота и кислорода. Формирование пи связи возможно только тогда, когда атомы находятся в определенном пространственном положении и расстоянии друг от друга, которое называется межъядерным расстоянием. При нарушении этого расстояния электроны перестают быть эффективными для образования пи связей и образуют менее стабильные связи.
Важно отметить, что пи связи являются слабыми по сравнению с сигма-связями, которые формируются при перекрытии s-орбиталей. Однако пи связи играют важную роль в формировании структуры молекул и определяют множество их свойств и реакций.
Процесс образования пи связей
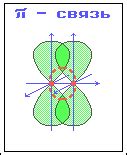
Пи связи образуются путем перекрестного перекрытия p-орбиталей, которые являются плоскими и сосредоточены над и под плоскостью ядер атомов. Это позволяет электронам быть ближе к ядрам, образуя дополнительные связи, но при этом он имеет форму плоской волны.
Образование пи связи начинается с перекрытия p-орбиталя одного атома с p-орбиталями соседних атомов. Они накладываются друг на друга, что приводит к образованию общей области перекрестия - π-молекулярной орбитали. Таким образом формируется система пи связей в молекуле.
Образование пи связей играет важную роль в химических реакциях и свойствах молекул. Она может повысить стабильность молекулы и влиять на ее реакционную способность. Известно, что пи связи могут участвовать в сопротивлении к нуклеофильной атаке, а также в протекании реакций аддиции и электрофильной атаки.
Примеры пи связей в химии
Примеры молекул, образованных пи связями:
- Бензол (C6H6) - это ароматическое соединение, состоящее из шести атомов углерода и шести атомов водорода. Внутри молекулы бензола электроны атомов карбона перекрываются друг с другом за счет пи связей.
- Ацетилен (C2H2) - это органическое соединение, состоящее из двух атомов углерода и двух атомов водорода. Пи связи между атомами углерода обеспечивают стабильность молекулы ацетилена.
- Азотная кислота (HNO3) - это неорганическое соединение, состоящее из атомов азота, кислорода и водорода. В молекуле азотной кислоты пи связи между атомами азота и кислорода обеспечивают ее устойчивость.
Это лишь несколько примеров молекул, в которых образуются пи связи. Они играют важную роль в различных процессах химической реакции и формировании органических и неорганических соединений.



