Серная кислота – это одна из наиболее распространенных кислот, используемых в химической промышленности и лабораториях. Она обладает множеством свойств и широким спектром применений. Образование серной кислоты происходит путем соединения серы с кислородом воздуха при высоких температурах. Это бесцветная жидкость, обладающая характерным резким запахом.
Серная кислота обладает сильной жгучестью и огромной реакционной активностью. Она способна растворять множество органических и неорганических веществ. Этот продукт является нестабильным, так как он образует азеотропные смеси с водой и выделяет при нагревании ядовитые пары оксидов серы.
Нитрат бария – сильно ядовитое неорганическое соединение, которое получается в результате химической реакции между серной кислотой и баритом. Этот белый кристаллический порошок применяется в различных отраслях промышленности, включая производство стекла, фармацевтику, пиротехнику и другие. Нитрат бария обладает высокой плотностью и является оптически активным.
Сочетание серной кислоты и нитрата бария образует особый химический союз, который используется в практических целях. Это соединение применяется в процессе очистки промышленных сточных вод, в процессах гальванического покрытия, а также в качестве катализатора при синтезе органических веществ.
Образование серной кислоты и нитрата бария
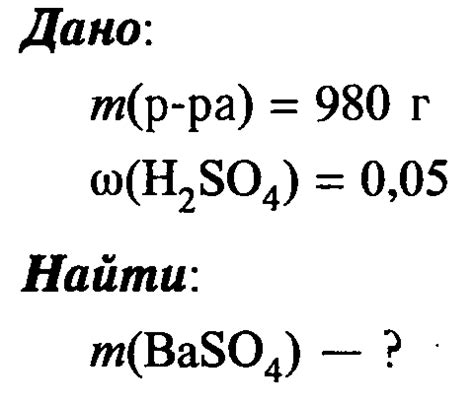
Серная кислота (H2SO4) и нитрат бария (Ba(NO3)2) образуются при реакции между серной кислотой и барием. Реакция происходит следующим образом:
H2SO4 + Ba → BaSO4 + H2O
В результате этой реакции образуется сернокислый барий (BaSO4) и вода (H2O). Сернокислый барий представляет собой белый ангидрид, который не растворяется в воде и обладает низкой растворимостью в кислотах.
Нитрат бария, в свою очередь, образуется в результате реакции между барием и азотной кислотой (HNO3):
Ba + 2HNO3 → Ba(NO3)2 + H2
В результате этой реакции образуется нитрат бария и водород. Нитрат бария является белым кристаллическим соединением, которое хорошо растворяется в воде.
Серная кислота и нитрат бария могут использоваться в различных отраслях промышленности. Например, серная кислота используется для производства удобрений, пластмасс, бумаги и красителей. Нитрат бария используется в производстве стекла, фотовспышек и пиротехнических изделий.
Происхождение и химические свойства
Серная кислота обладает мощными окислительными свойствами и может взаимодействовать с многими веществами. Она может реагировать с металлами, образуя соль и выделяя водород. Также серная кислота может действовать как кислота, образуя соли с основаниями.
Нитрат бария (Ba(NO3)2) - это белый порошок, который может быть получен путем реакции нитрата бария (Ba(NO3)2) с соответствующими реагентами. Это соединение обладает высокой растворимостью в воде и практически нерастворимо в органических растворителях.
Нитрат бария нередко используется в химических экспериментах в качестве источника бария, а также в пиротехнике для создания ярких зеленых огней. Взаимодействие нитрата бария с серной кислотой приводит к образованию белого осадка барийсульфата (BaSO4) и нитрата.
Методы получения серной кислоты
- Контактная производство:
- Вещества: сера, кислород, двуокись азота
- Процесс: сера и кислород окисляются при высокой температуре и давлении с использованием двуокиси азота в качестве катализатора. Реакция происходит в присутствии специального катализатора (например, проволоки из платины).
- Вещества: сера, вода, соли натрия
- Процесс: сера растворяется в воде, затем к полученному раствору добавляются соли натрия (например, Na2SO4), что приводит к образованию серной кислоты.
- Вещества: аммиак, кислород, двуокись из азота
- Процесс: аммиак окисляется кислородом в присутствии двуокиси азота как катализатора. Полученная азотокислота затем превращается в серную кислоту путем окисления.
- Вещества: пиритный шлак, вода
- Процесс: пиритный шлак, который содержит серу, растворяется в воде, после чего происходит окисление серы до серной кислоты.
Таким образом, существует несколько методов получения серной кислоты, каждый из которых имеет свои особенности и применяется в зависимости от конкретных условий и требований производства.
Применение серной кислоты
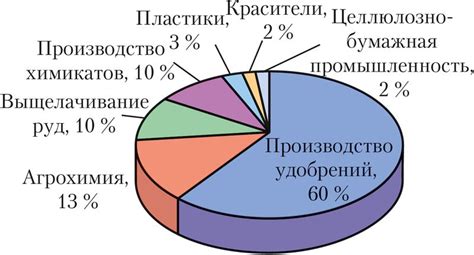
1. Производство удобрений. Серная кислота является одним из основных компонентов производства минеральных удобрений. Она используется для получения аммиачной селитры и суперфосфата, которые в свою очередь являются важными компонентами для повышения урожайности сельскохозяйственных культур.
2. Производство химических веществ. Серная кислота используется в качестве исходного материала при получении многих химических веществ, таких как ацетон, формальдегид, водородный пероксид и другие. Она также используется в процессах синтеза органических соединений.
3. Металлургия. Серная кислота используется в растворительной и очистительной химии металлургических процессов. Она применяется для очистки металлических поверхностей от загрязнений и ржавчины, а также для производства электролитов, используемых в электролизе различных металлов.
4. Аккумуляторная промышленность. Серная кислота является важным компонентом при производстве свинцово-кислотных аккумуляторных батарей. Она используется для заполнения электролитного раствора внутри батарей и обеспечивает их нормальное функционирование.
5. Фармацевтическая промышленность. Серная кислота применяется в различных процессах производства лекарственных препаратов, в основном для получения активных фармацевтических веществ.
Таким образом, серная кислота нашла широкое применение в различных отраслях промышленности, играя важную роль в процессах производства и повышения эффективности многих продуктов и материалов.
Методы получения нитрата бария

Нитрат бария (Ba(NO3)2) может быть получен несколькими методами:
| Метод | Описание |
|---|---|
| Прямая реакция | Нитрат бария может быть получен путем реакции бария с концентрированной серной кислотой (H2SO4) в соответствующих условиях. В результате реакции образуется нитрат бария и сероводород (H2S). |
| Двойная замещение | Нитрат бария также можно получить путем реакции барий хлорида (BaCl2) с нитратом свинца (Pb(NO3)2) в водном растворе. В результате реакции образуется нитрат бария и хлорид свинца (PbCl2). |
| Реакция осаждения | Нитрат бария может быть получен путем осаждения ионов бария и нитрата из соответствующих растворов. Например, раствор бария хлорида (BaCl2) может быть реагирован с раствором нитрата аммония (NH4NO3) для образования осадка нитрата бария. |
Выбор метода получения нитрата бария зависит от доступности исходных реагентов, экономических и безопасности соображений. Каждый из указанных методов обладает своими особенностями и возможностями применения.
Химические свойства нитрата бария

Он представляет собой бесцветные кристаллы, хорошо растворяющиеся в воде и спирте. Раствор нитрата бария обладает слабыми щелочными свойствами и может реагировать с кислотами, образуя соли бария.
Взаимодействие нитрата бария с различными соединениями часто приводит к образованию нерастворимых осадков. Например, реакция нитрата бария с серной кислотой приводит к образованию нерастворимого осадка серного бария:
- Ба(NO3)2 + H2SO4 → BaSO4 + 2HNO3
Также, нитрат бария является хорошим окислителем и может выделить кислород при нагревании или взаимодействии с некоторыми веществами. Например, он может окислить серу или фосфор до соответствующих оксидов:
- 4Ba(NO3)2 + S → 2BaSO4 + 4NO2 + O2
- 6Ba(NO3)2 + 2P → 3Ba3(PO4)2 + 12NO2 + O2
Нитрат бария также используется в химическом анализе в качестве реагента для обнаружения серных и фосфатных ионов. Он может быть использован для определения содержания серы или фосфора в образцах путем исчисления образовавшегося осадка.



