В химии существуют определенные закономерности и свойства атомов химических элементов, которые позволяют нам лучше понять строение и поведение вещества. Одной из таких основополагающих закономерностей является периодичность свойств атомов. Но что именно определяет эти закономерности и как они помогают нам в научных исследованиях?
Периодичность свойств атомов химических элементов основана на их электронном строении. С точки зрения атомной модели, атом состоит из ядра, в котором сосредоточена большая часть массы, и электронов, вращающихся по разным энергетическим оболочкам. Количество электронов во внешней оболочке (валентных электронов) определяет химические свойства атома. Именно эти валентные электроны определяют, какие соединения может образовать атом с другими атомами.
На основе этих свойств, атомы различаются по химическим свойствам и располагаются в периодической таблице химических элементов. Периодическая таблица, созданная Д.И.Менделеевым, систематизирует элементы по возрастанию их атомных номеров, а также располагает их в порядке возрастания электронного строения. Таким образом, элементы с похожими свойствами обнаруживаются в одних и тех же группах или вертикалях таблицы.
Закономерности по строению электронных оболочек
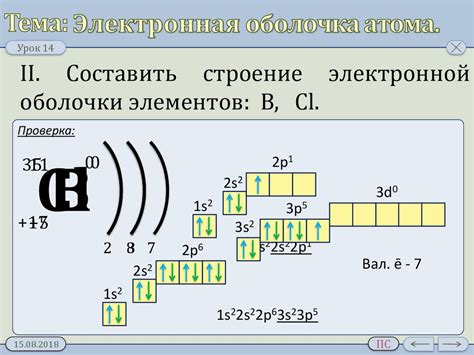
Строение электронных оболочек атомов химических элементов подчиняется определенным закономерностям, которые определяют химические свойства атомов и их активность в химических реакциях. Познание этих закономерностей позволяет предсказывать поведение элементов и прогнозировать возможные соединения и реакции.
Одной из основных закономерностей по строению электронных оболочек является принцип заполнения оболочек, согласно которому электроны заполняют энергетические уровни оболочек по постепенному увеличению энергии. Первая оболочка может содержать не более 2 электронов, вторая - не более 8 электронов, третья - не более 18 электронов, и так далее.
Кроме того, существует также закономерность, связанная с распределением электронов по подуровням, которые характеризуются разным энергетическим уровнем. Последовательно заполняются сначала s-подуровни, затем p-подуровни, затем d-подуровни и, наконец, f-подуровни. Каждый подуровень может содержать ограниченное количество электронов в зависимости от своего разбития на орбитали (s - 2 электрона, p - 6 электронов, d - 10 электронов, f - 14 электронов).
Электронная конфигурация атома, то есть расположение электронов в его электронных оболочках, определяет его поведение в химических реакциях и взаимодействиях с другими атомами. Она также связана с положением элемента в периодической системе и его химическими свойствами.
- Принцип заполнения оболочек
- Распределение электронов по подуровням
- Электронная конфигурация и химические свойства
Взаимодействие атомов в периодической системе
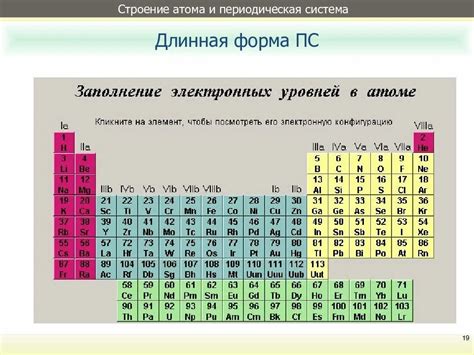
Периодическая система химических элементов представляет собой систематическое распределение атомов в зависимости от их атомных свойств. Взаимодействие атомов внутри периодической системы обуславливает многочисленные химические и физические явления.
Взаимодействие атомов проявляется в формировании химических соединений. Атомы сходных свойств объединяются в группы и становятся составными частями химических элементов. Это объединение атомов происходит благодаря обмену электронами между ними.
Периодическая система представляет собой способ представления этого взаимодействия. В ней атомы располагаются в строгом порядке, который отражает их атомные свойства: массу, заряд, электронную конфигурацию и радиус. Такое упорядочивание позволяет химикам и физикам проводить прогнозы о поведении веществ на основе знания свойств атомов, их взаимодействия и соединений.
Одним из фундаментальных законов периодической системы является закон Менделеева. Он заключается в том, что свойства элементов систематически изменяются при переходе от одного элемента к другому. Это изменение обусловлено изменением количества электронов в атоме и, следовательно, их взаимодействием с другими атомами.
Взаимодействие атомов в периодической системе также определяет последовательность химических реакций и возможность образования новых соединений. Понимание этого взаимодействия является ключевым в развитии химии и создании новых материалов и соединений.
Влияние заряда ядра на свойства атомов

Заряд ядра атома имеет значительное влияние на его свойства и реакционную способность. В зависимости от значения заряда ядра, атомы различаются по своим физическим и химическим характеристикам.
Заряд ядра определяет количество протонов и нейтронов в атоме. Протоны обладают положительным зарядом, а нейтроны не имеют заряда. Количество электронов, окружающих ядро, также равно заряду ядра, чтобы атом был электрически нейтрален.
Заряд ядра определяет массовое число атома и его химические свойства. Атомы с различным зарядом ядра имеют разное количество протонов и нейтронов в своем ядре, что приводит к различиям в их массе и структуре.
Чем больше заряд ядра, тем больше электронов может привлечь оно к себе. Это обусловливает более высокую электроотрицательность и склонность образовывать связи с другими атомами. Атомы с большим зарядом ядра обычно имеют более высокую энергию и реакционную способность.
С изменением заряда ядра, изменяется также радиус атома. Чем больше заряд ядра, тем сильнее оно притягивает электроны, что сокращает радиус атома.
Таким образом, заряд ядра играет ключевую роль в определении свойств атомов. Он влияет на их массу, структуру, энергию и реакционную способность, а также на их химические и физические свойства.
| Заряд ядра | Свойства атомов |
|---|---|
| Положительный (больше) | Высокая электроотрицательность, большая энергия, высокая реакционная способность |
| Отрицательный (меньше) | Низкая электроотрицательность, малая энергия, низкая реакционная способность |
Влияние размера атома на его химические свойства
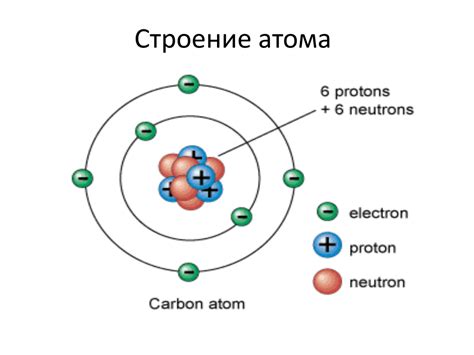
Размер атома – один из самых важных параметров, определяющих его химические свойства. Размер атома зависит от его ядерного заряда и электронной оболочки.
Чем больше размер атома, тем слабее притягиваются его электроны ядром. Это связано с тем, что чем дальше находится электрон от ядра, тем больше у него возможностей уходить от притяжения ядра. Кроме того, при увеличении размера атома увеличивается количество электронов, что также смягчает взаимодействие электронной оболочки с ядром.
Изменение размера атома может оказывать влияние на такие химические свойства, как радиус атома, ионизационная энергия и электроотрицательность. Например, с увеличением размера атома его радиус увеличивается, что делает его более тяжелым и устойчивым к любым внешним воздействиям. Также увеличение размера атома приводит к снижению его ионизационной энергии – энергии, необходимой для отделения внешнего электрона от атома. Ионизационная энергия обратно пропорциональна радиусу атома.
Влияние размера атома на электроотрицательность заключается в том, что с увеличением размера атома его способность притягивать электроны к себе уменьшается. Это означает, что большие атомы обладают меньшей электроотрицательностью по сравнению с маленькими атомами.
Важно отметить, что размер атома также может оказывать влияние на его химическую активность. Маленькие атомы, благодаря более сильному притяжению электронов ядром, имеют большую склонность к реакциям и образованию химических связей. Большие атомы, наоборот, менее активны, так как их электроны ощущают слабое притяжение со стороны ядра.
Влияние электроотрицательности на свойства атомов
Полярность связи влияет на различные свойства атомов и соединений. Например, атомы с высокой электроотрицательностью имеют склонность к образованию ионов или ионных связей, так как они легко притягивают ионы с противоположными зарядами. Это объясняет, почему многие известные соли образуются между атомами с различными электроотрицательностями.
Кроме того, электроотрицательность влияет на расположение атомов в периодической таблице. Элементы с высокой электроотрицательностью обычно находятся в верхней правой части таблицы, так как они имеют большую притяжение к электронам и имеют небольшой радиус. Элементы с низкой электроотрицательностью находятся в нижней левой части таблицы, так как они имеют меньшую притяжение к электронам и имеют больший радиус.
Таким образом, электроотрицательность является важным фактором, который определяет химические свойства атомов и их размещение в периодической таблице. Изучение этого свойства помогает понять многие аспекты химических реакций и взаимодействий между атомами.
Зависимость химических свойств от расположения атомов в периодической системе

Расположение элементов в периодической системе отражает основные закономерности и тренды в химических свойствах атомов. Вертикальные столбцы, называемые группами, содержат элементы с сходными электронными конфигурациями и химическими свойствами. Горизонтальные строки, называемые периодами, отражают изменение электронной конфигурации и химических свойств элементов.
По мере движения слева направо через период, химические свойства атомов изменяются. В начале периода, элементы имеют наименьшую электроотрицательность и наименьшую энергию ионизации. Однако, по мере движения к концу периода, электроотрицательность возрастает, а энергия ионизации увеличивается.
Газообразность элементов также изменяется в зависимости от их расположения в периодической системе. На левой стороне периодической системы находятся металлы, которые часто образуют ионы с положительным зарядом и обладают низкой электроотрицательностью. На правой стороне находятся неметаллы, которые обычно образуют отрицательно заряженные ионы и обладают высокой электроотрицательностью.
Химическая активность элементов также демонстрирует закономерности, связанные с их расположением в периодической системе. В общем, металлы имеют большую химическую активность, особенно на левой стороне периодической системы. Неметаллы, наоборот, имеют большую электроотрицательность и образуют сильно положительно заряженные ионы.



