Периодическая система химических элементов является одной из важнейших и наиболее известных наук о химических элементах и их свойствах. В основе этой системы лежит концепция организации элементов по их атомным номерам, что позволяет выявить закономерности и связи между различными элементами.
Периоды в периодической системе представляют собой горизонтальные ряды элементов, расположенные по возрастанию атомных номеров. Каждый период соответствует новому энергетическому уровню электронов и включает различное количество подуровней энергии. Периоды играют важную роль в определении расположения элементов и определении их свойств.
Группы – это вертикальные колонки в периодической системе, объединяющие элементы с аналогичными химическими свойствами. Одной из основных характеристик группы является количество электронов на внешнем энергетическом уровне, что определяет их реакционную активность и способность образовывать химические связи.
Периоды и группы в химии играют важную роль в понимании закономерностей и связей между элементами. Они помогают классифицировать элементы в соответствии с их химическими свойствами и предоставляют ценную информацию при изучении различных аспектов химии. Понимание периодов и групп в периодической системе открывает двери к более глубокому пониманию мира химических элементов и применению их в различных отраслях науки и технологий.
Периоды в химии: что это и зачем нужны
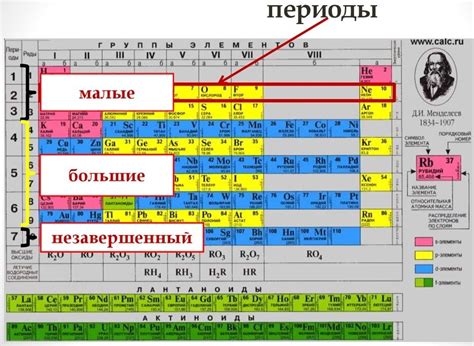
Периоды очень важны для определения химической реактивности элементов, их валентности и химических свойств. Устройство периодической таблицы позволяет химикам легко определить как различные химические свойства элементов внутри периода, так и изменение этих свойств при движении по периоду.
Каждый период характеризуется увеличением количества оболочек электронов. Это приводит к изменению электронной конфигурации элементов и, как следствие, к изменению их химических свойств. Например, в первом периоде находится только два элемента - водород и гелий. Водород имеет одну оболочку, а гелий - две оболочки. Из-за этого они имеют различные химические свойства.
Знание о периодах помогает усвоить информацию о химических свойствах элементов, а также предсказать их реакции с другими веществами. Периоды облегчают классификацию и организацию элементов в химии, что делает их более удобными для изучения и использования в различных научных и технических отраслях.
Сущность понятия периода

Каждый период состоит из разных количеств элементов, начиная с одного элемента в первом периоде и заканчивая элементом с самым высоким атомным номером в последнем периоде. Элементы внутри периодов располагаются по возрастанию атомного номера.
Существует 7 периодов в таблице Менделеева:
- Первый период состоит из 2 элементов - водорода (H) и гелия (He).
- Второй период состоит из 8 элементов - лития (Li), бериллия (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F) и неон (Ne).
- Третий период состоит из 8 элементов - натрия (Na), магния (Mg), алюминия (Al), кремния (Si), фосфора (P), серы (S), хлора (Cl) и аргона (Ar).
- Четвертый период состоит из 18 элементов, включая калий (K), кальций (Ca), титан (Ti), железо (Fe), никель (Ni), медь (Cu), цинк (Zn) и серебро (Ag).
- Пятый период состоит из 18 элементов, таких как рубидий (Rb), стронций (Sr), кадмий (Cd), иттрий (Y), рутений (Ru), кадмий (Cd), палладий (Pd), серебро (Ag).
- Шестой период состоит из 32 элементов, включая цезий (Cs), барий (Ba), лантан (La), церий (Ce), платину (Pt), золото (Au), ртуть (Hg) и свинец (Pb).
- Седьмой период, наиболее длинный, состоит из 32 элементов, включая франций (Fr), радий (Ra), актиний (Ac), торий (Th), уран (U), нептуний (Np), плутоний (Pu) и америций (Am).
Периоды в таблице Менделеева играют важную роль в определении реакционных свойств элементов и дают информацию о расположении электронов в атомах. Понимание сущности понятия периода является основой для изучения химии и создания комплексных моделей органических и неорганических соединений.
Группы в химии: их значение и классификация
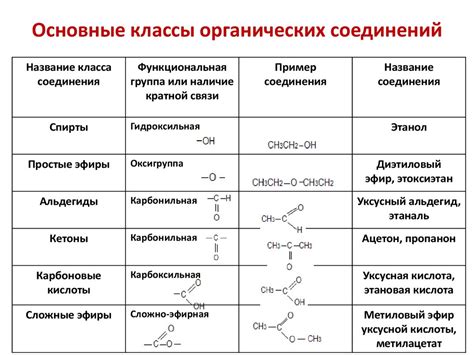
Группы химических элементов классифицируются по различным критериям, включая электронную конфигурацию, химические свойства и положение в периодической системе. Существует несколько систем классификации групп, одна из которых основана на типе последней заполненной оболочки электронов.
- Семья алкалий (I группа): эти элементы характеризуются наличием одного электрона во внешней электронной оболочке. Они очень реактивны и легко образуют ионы с положительным зарядом.
- Семья щелочноземельных металлов (II группа): элементы этой группы имеют два электрона во внешней оболочке. Они также реактивны, но не настолько, как алкалии.
- Семья бора (III группа): элементы этой группы имеют три электрона во внешней оболочке. Они могут образовывать ионы с положительным и отрицательным зарядом.
Также существуют другие группы, такие как группы углерода (IV группа), группы азота (V группа), группы кислорода (VI группа) и группы инертных газов (VIII группа).
Классификация элементов в группы позволяет их упорядочить и выделить главные химические свойства, что упрощает изучение и понимание периодической системы химических элементов.
Значение групп в химии
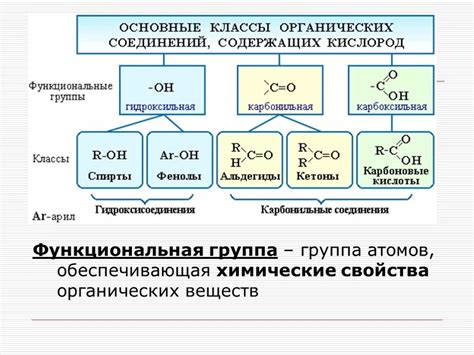
Группы в химии имеют важное значение и помогают систематизировать и классифицировать элементы. Группы разделяют элементы на основе их электронной конфигурации и химических свойств, что позволяет предсказать их поведение и реакции.
Периодическая таблица химических элементов состоит из семи групп, обозначаемых числами от 1 до 7, и каждая группа имеет свои особенности. Группа 1, например, содержит щелочные металлы, которые легко образуют положительные ионы. Группа 7, или галогены, характеризуется высокой реактивностью и способностью образовывать отрицательные ионы.
Важно отметить, что периодическая таблица является динамической и постоянно обновляется с появлением новых элементов и расширением нашего знания о различных свойствах химических элементов.



