Молекулярная масса - это сумма атомных масс всех атомов, входящих в молекулу вещества. Она играет важную роль в химии, так как позволяет определить количество вещества на основе его массы. В данной статье мы рассмотрим расчет относительной молекулярной массы N2 - молекулы азота.
Азот - химический элемент с атомным номером 7 и обозначением N. Молекулярная формула азота - N2, что означает, что молекула азота состоит из двух атомов азота. Для расчета относительной молекулярной массы N2 необходимо учитывать атомные массы азота.
Атомная масса азота равна примерно 14 атомным единицам, так как в атоме азота содержится 7 протонов и 7 нейтронов. Таким образом, относительная молекулярная масса N2 будет равна удвоенной атомной массе азота, то есть около 28 атомных единиц.
Что такое относительная молекулярная масса N2?

Относительная молекулярная масса N2 представляет собой числовое значение, которое показывает, насколько раз масса молекулы азота (N2) больше относительной единицы массы. Она используется для определения массы N2 в химических расчетах и формулах.
Относительная молекулярная масса N2 вычисляется путем суммирования массы всех атомов азота в молекуле. Молекула азота (N2) состоит из двух атомов азота, каждый из которых имеет относительную атомную массу около 14. На основе этого, относительная молекулярная масса N2 равна приблизительно 28.
Знание относительной молекулярной массы N2 важно для решения задач химических расчетов, таких как определение количества вещества, массы или объема газовых смесей, подсчет реакционной массы и других. Она также может использоваться для определения стехиометрических соотношений в химических реакциях.
Относительная молекулярная масса N2 является безразмерной величиной и выражается в единицах, равных относительной атомной массе. Понимание ее значения и использование в химических расчетах помогает ученым и химикам более точно определить и предсказать химические свойства и поведение N2 в различных условиях.
Определение и примеры

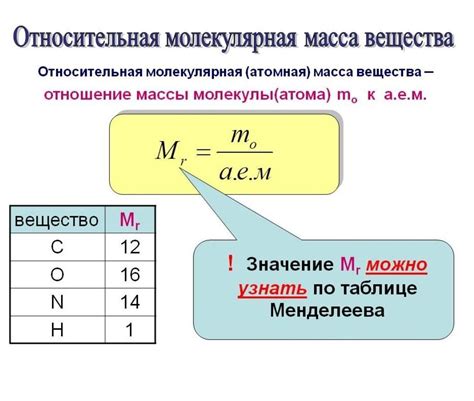
Относительная молекулярная масса (ММ) позволяет определить массу молекулы в единицах массы, обычно в атомных единицах массы (аМЕ). Для расчета ММ N2 (дистикстого азота) необходимо сложить относительные атомные массы его атомов.
Относительная атомная масса (АМ) азота составляет примерно 14 аМЕ. Так как в молекуле N2 присутствуют 2 атома азота, необходимо умножить АМ на 2: 14 аМЕ * 2 = 28 аМЕ.
Таким образом, относительная молекулярная масса N2 равна 28 аМЕ.
Другим примером может служить расчет относительной молекулярной массы CO2 (двуокиси углерода). АМ углерода составляет примерно 12 аМЕ, а АМ кислорода - 16 аМЕ. В молекуле CO2 содержится один атом углерода и два атома кислорода, поэтому расчет будет следующим: 12 аМЕ + 16 аМЕ * 2 = 44 аМЕ.
Формула расчета относительной молекулярной массы N2
Относительная молекулярная масса (Мr) N2, также известного как динитроген, может быть рассчитана с использованием следующей формулы:
- Вычислите молекулярную массу каждого атома нитрогена (N). Молекулярная масса атома N равна приблизительно 14.01 единицы массы.
- Умножьте молекулярную массу атома N на количество атомов N в молекуле N2, которое составляет 2.
- Полученное значение умножьте на 2, чтобы учесть присутствие двух атомов нитрогена в молекуле N2.
Таким образом, формула для расчета относительной молекулярной массы N2 будет следующей:
Мр(N2) = (масса N * 2) * 2
Где:
- Мр(N2) - относительная молекулярная масса N2
- масса N - молекулярная масса атома нитрогена
Применяя указанную формулу, можно рассчитать относительную молекулярную массу N2 и использовать полученные значения в дальнейших расчетах и анализе структурных свойств вещества.
Способы расчета относительной молекулярной массы N2
1. Расчет по формуле
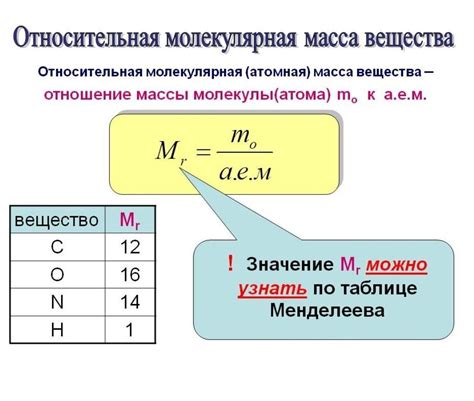
Относительная молекулярная масса N2 может быть рассчитана с использованием химической формулы азота, а именно - N2. Формула N2 указывает на то, что в молекуле азота содержится два атома азота. Поэтому относительная молекулярная масса N2 будет равна сумме атомных масс двух атомов азота.
Атомная масса азота равна примерно 14,01 атомной единицы. Следовательно, относительная молекулярная масса N2 будет примерно 28,02 атомной единицы.
2. Использование химической таблицы
Химическая таблица элементов содержит информацию об атомных массах различных химических элементов, включая азот. Для расчета относительной молекулярной массы N2 можно найти атомную массу азота в таблице и умножить ее на количество атомов азота в молекуле N2 (в данном случае - 2).Найденная в химической таблице атомная масса азота равна 14,01 атомной единице. Умножение на количество атомов дает результат в 28,02 атомной единицы - это и будет относительная молекулярная масса N2.
3. Использование масс-спектрометрии
Масс-спектрометрия - это метод анализа, основанный на измерении массы и концентрации ионов вещества. С помощью масс-спектрометрии можно определить относительную молекулярную массу N2 путем измерения массы молекулы азота.
Этот метод требует использования специализированного оборудования и проведения специальных экспериментов, поэтому не является наиболее доступным способом расчета относительной молекулярной массы N2.
В итоге, относительная молекулярная масса N2 составляет примерно 28,02 атомной единицы и может быть рассчитана с использованием простых формул, химической таблицы или более сложных методов, таких как масс-спектрометрия.
Физическое значение относительной молекулярной массы N2

Относительная молекулярная масса N2 представляет собой величину, определяющую отношение массы молекулы азота к массе углерода-12. Обозначается символом Мr и выражается в атомных единицах массы (а. е. м.).
Относительная молекулярная масса N2 равна 28 а. е. м. Это означает, что масса молекулы азота, состоящей из двух атомов, в 28 раз больше массы углерода-12, который принимается за основу при определении относительных молекулярных масс.
Физическое значение относительной молекулярной массы N2 имеет важное значение в химии и физике. Она используется для расчета стехиометрических соотношений в химических реакциях, определения объема и плотности газов, а также для проведения физических исследований и экспериментов.
Знание относительной молекулярной массы N2 позволяет установить массовое соотношение веществ в химической реакции и определить их количество. Например, при изучении сжигания азота в присутствии кислорода, зная относительную молекулярную массу N2 и массовый состав смеси, можно рассчитать количество образующихся оксидов азота и продукты реакции.
Таким образом, физическое значение относительной молекулярной массы N2 играет важную роль в понимании и исследовании химических и физических процессов, а также в промышленности и науке.
Значение относительной молекулярной массы N2 в химических реакциях

Относительная молекулярная масса (Мr) играет важную роль в химических реакциях с участием азота (N2). Она представляет собой отношение массы молекулы азота к единице массы углерода-12 (12С). Таким образом, относительная молекулярная масса N2 выражается в относительных атомных массах и равна 28.
Относительная молекулярная масса N2 имеет большое значение при проведении химических реакций, связанных с азотом. Она позволяет определить количество азота, необходимое для проведения реакции, и рассчитать количество продуктов, образующихся в результате такой реакции. Более того, зная относительную молекулярную массу N2, можно также определить массу и объем азота, участвующего в реакции, исходя из известного количества вещества.
Кроме того, относительная молекулярная масса N2 позволяет проводить расчеты по последовательности реакций, где азот является одним из реагентов или продуктов. Она помогает определить исходные массы и количества веществ, а также предсказать ход и результаты реакции.
Таким образом, значение относительной молекулярной массы N2 в химических реакциях является важным компонентом для проведения анализа и расчетов. Оно позволяет ученным и химикам более точно определить параметры реакции, основываясь на свойствах и характеристиках молекулы N2.
Зависимость относительной молекулярной массы N2 от температуры и давления

Относительная молекулярная масса азота (N2) зависит от температуры и давления. В нормальных условиях (температура 0 °C и давление 1 атмосфера) молекулярная масса N2 составляет 28 г/моль.
При изменении температуры и давления, молекулярная масса N2 также может изменяться. При повышении температуры и/или давления, молекулы азота двигаются более энергично, что ведет к увеличению средней молекулярной массы. При понижении температуры и/или давления, молекулы азота двигаются менее энергично, что приводит к снижению средней молекулярной массы.
Изменение молекулярной массы N2 может быть описано уравнением идеального газа:
M = m / n
где M - молекулярная масса, m - масса газа в граммах, n - количество вещества в молях.
Для расчета молекулярной массы N2 при различных температурах и давлениях необходимо использовать дополнительные соотношения, такие как уравнение состояния идеального газа или уравнение Ван-дер-Ваальса.
Зависимость относительной молекулярной массы N2 от температуры и давления является важным фактором при проведении различных химических реакций, а также при моделировании атмосферных условий и метеорологических процессов.
Методы определения относительной молекулярной массы N2 в лабораторных условиях

Один из наиболее распространенных методов - гравиметрический метод, основанный на измерении массы образца N2. Для этого вещество сначала подвергается длительной сушке, затем измеряется его масса при известном объеме. Путем вычислений и использования данных из таблицы атомных масс определяется относительная молекулярная масса N2.
Еще одним методом является газовая хроматография. В этом методе образец N2 разделяется на компоненты, которые проходят через носительный газ в колонке хроматографа. Определение относительной молекулярной массы N2 происходит по времени удерживания каждого компонента в колонке.
Также для определения относительной молекулярной массы N2 можно использовать метод масс-спектрометрии. В этом методе образец N2 ионизируется, а затем его ионы разделены по отношению массы к заряду в масс-спектрометре. Используя данные о заряде ионов и их отношении массы, определяется относительная молекулярная масса N2.
Каждый из этих методов имеет свои преимущества и ограничения, и выбор метода определения относительной молекулярной массы N2 зависит от конкретных условий проведения исследования.
Использование относительной молекулярной массы N2 в промышленности и научных исследованиях

Относительная молекулярная масса N2, или молекулярная масса азота, играет важную роль в различных сферах промышленности и научных исследованиях. Знание молекулярной массы N2 необходимо для выполнения различных расчетов, определения состава газовых смесей и процессов, а также для определения и контроля качества продукции.
В промышленности относительная молекулярная масса N2 используется в процессах производства удобрений, азотной кислоты, аммиака, пластмасс и других продуктов. Например, в производстве удобрений знание молекулярной массы N2 позволяет определить точное количество азота, необходимого для синтеза удобрений определенного типа. Точный расчет этой величины помогает сэкономить ресурсы и повысить эффективность процесса.
В научных исследованиях молекулярная масса N2 используется для изучения и анализа различных физико-химических свойств азота. Она является важным параметром при проведении исследований в области катализа, плазменной химии, фотохимии и других областях. Знание точной молекулярной массы N2 позволяет установить особенности реакций, исследовать кинетику процессов, а также определять взаимодействие азота с другими веществами.
Кроме того, относительная молекулярная масса N2 широко используется в аналитической химии для определения концентрации азота в различных образцах, таких как почва, вода, воздух и другие. Анализ содержания азота является важным при изучении экологических проблем, контроле загрязнений и оценке качества окружающей среды.
Таким образом, относительная молекулярная масса N2 играет существенную роль в различных сферах промышленности и научных исследований. Ее использование позволяет проводить точные расчеты, изучать и анализировать различные процессы и свойства азота, а также контролировать качество продукции и окружающей среды.



