Электролиты – это вещества, которые в растворе или плавящемся состоянии могут ионизироваться и образовывать электрически заряженные частицы – ионы. Они играют важную роль во многих химических процессах и имеют различные степени ионизации. В зависимости от этого, электролиты подразделяются на две основные категории: слабые и сильные.
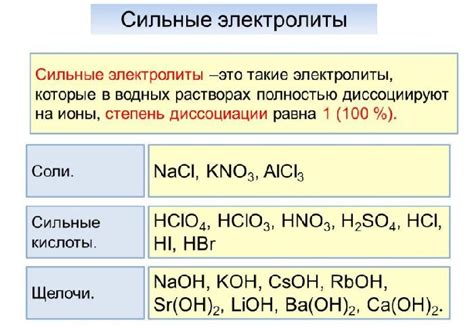
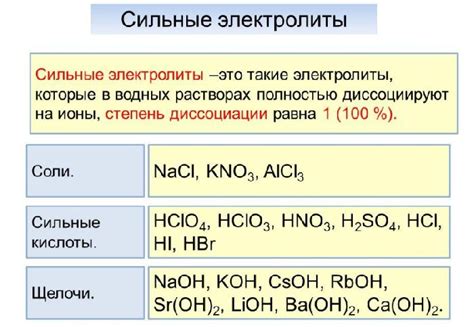
Сильные электролиты полностью диссоциируют в растворе, образуя значительное количество ионов. Такие вещества характеризуются высокой степенью ионизации и поэтому влияют на проводимость электрического тока.
Примерами сильных электролитов являются:
- соли, такие как хлорид натрия (NaCl), нитрат калия (KNO3) их др.
- сильные кислоты, например соляная (HCl), серная (H2SO4) и др.
- сильные щелочи, включая гидроксид натрия (NaOH), гидроксид калия (KOH) и др.
Важно отметить, что сильные электролиты образуют полностью ионный раствор, что означает, что все молекулы диссоциируют на ионы в растворе.
Слабые электролиты, в свою очередь, диссоциируют в растворе лишь частично и образуют невеликое количество ионов. В отличие от сильных электролитов, слабые электролиты не образуют полностью ионного раствора.
Слабые и сильные электролиты: основное различие

Диссоциация - это процесс, при котором электролитические соединения разлагаются на ионы в растворе. Ионы - это заряженные частицы, которые могут перемещаться в растворе и проводить электрический ток.
Основное различие между слабыми и сильными электролитами заключается в степени диссоциации. Сильные электролиты диссоциируются полностью, то есть все молекулы электролита распадаются на ионы при растворении в воде. Примерами сильных электролитов являются соль (NaCl), кислоты (HCl) и щелочи (NaOH).
Слабые электролиты, в свою очередь, диссоциируются только частично, то есть только небольшая часть молекул электролита распадается на ионы. Примерами слабых электролитов могут служить уксусная кислота (CH3COOH) и метильный спирт (CH3OH).
Это отличие в степени диссоциации приводит к различным свойствам и возможностям электролитов. Сильные электролиты хорошо проводят электрический ток и имеют высокую электропроводность, так как в растворе присутствует большое количество свободных ионов.
Слабые электролиты, напротив, имеют низкую электропроводность, так как только небольшая часть их молекул диссоциирует на ионы. Это свойство слабых электролитов часто используется в аналитической химии для удобства разделения и определения различных веществ в растворах.
Таким образом, основное различие между слабыми и сильными электролитами заключается в степени диссоциации и свойствах электропроводности. Понимание этого различия помогает в изучении и применении электролитических соединений в химических исследованиях и процессах.
Слабые электролиты: понятие и характеристики

Слабые электролиты обладают рядом характеристик, которые могут быть использованы для их определения. Одной из ключевых характеристик слабых электролитов является малая степень диссоциации. В растворе они образуют всего лишь небольшое количество ионов, в сравнении с общим количеством вещества, содержащегося в растворе. Это объясняет низкую электропроводность растворов слабых электролитов по сравнению со сильными электролитами.
Кроме того, слабые электролиты могут образовывать равновесные реакции в растворе. Это означает, что обратная реакция, при которой ионы слабого электролита возвращаются в недиссоциированное состояние, также может происходить. В результате таких равновесных реакций в растворе могут образовываться ионы обоих типов - недиссоциированные и диссоциированные.
Слабые электролиты часто имеют специфические свойства растворов, связанные с их недиссоциированной формой. Это может проявляться, например, в изменении pH раствора или изменении его электропроводности при добавлении слабого электролита.
Слабые электролиты, как правило, являются молекулами, состоящими из атомов с низкой электроотрицательностью, что приводит к слабой поляризации связей внутри молекулы и слабым межмолекулярным взаимодействиям. Из-за этого молекулы слабых электролитов могут легко находиться в недиссоциированном состоянии, несмотря на наличие ионогенной группы.
Примеры слабых электролитов и их свойства

Слабые электролиты представляют собой вещества, которые диссоциируют только частично в растворе. Они образуют недолговечные ионные связи и имеют свойства, отличные от сильных электролитов.
Вот несколько примеров слабых электролитов и их особенности:
| Пример слабого электролита | Свойства |
|---|---|
| Уксусная кислота (CH₃COOH) | Диссоциирует только частично, образуя ионы в малых количествах. Обладает слабой электропроводностью в растворе. |
| Аммиак (NH₃) | Диссоциирует только частично, образуя ионы аммония (NH₄⁺) и гидроксида (OH⁻). Протонирует воду, образуя аммоний и гидроксидные ионы. Обладает слабой электропроводностью в растворе. |
| Карбонат натрия (Na₂CO₃) | Диссоциирует только частично, образуя ионы натрия (Na⁺), карбоната (CO₃²⁻) и гидроксидные ионы (OH⁻). Реагирует с водой, диссоциируя и образуя гидроксид натрия. Обладает слабой электропроводностью в растворе. |
Свойства слабых электролитов делают их особенно полезными во многих процессах, таких как регулирование pH-баланса, водоочистка и производство лекарственных препаратов.
Сильные электролиты: определение и особенности

Сильными электролитами называются вещества, которые в растворе претерпевают полное ионизацию и образуют растворы с высокой проводимостью электрического тока.
Особенностью сильных электролитов является то, что они разделяются на положительно и отрицательно заряженные ионы, которые обладают способностью двигаться в противоположных направлениях под влиянием электрического поля. Это обеспечивает высокую электропроводность и такие растворы могут эффективно участвовать в электролитических реакциях.
К наиболее известным сильным электролитам относятся соли, кислоты и щелочи. При диссоциации они образуют ионы, которые способны проводить электрический ток. Примерами сильных электролитов являются соляная кислота (HCl), серная кислота (H2SO4), гидроксид натрия (NaOH) и другие.
Сильные электролиты широко применяются в различных областях, таких как химическая промышленность, медицина и аналитическая химия. Их свойства и поведение в растворе играют важную роль при проведении множества химических и физических процессов.
Примеры сильных электролитов и их свойства
- Соляная кислота (HCl): этот сильный электролит полностью диссоциирует в воде на ионы водорода (H+) и хлорида (Cl-). Он обладает сильными еще и вредными для здоровья свойствами, поэтому требуется осторожность при его использовании.
- Калий гидроксид (KOH): это еще один сильный электролит, который полностью диссоциирует в растворе на ионы калия (K+) и гидроксида (OH-). Он часто используется в лабораториях для регулировки уровня pH и в качестве основного компонента щелочных растворов.
- Серная кислота (H2SO4): это синтетическое вещество, которое также является сильным электролитом. Как и соляная кислота, она полностью диссоциирует в растворе на ионы, в данном случае на ионы водорода (H+) и сульфата (SO4-).
Сильные электролиты обычно имеют ярковыраженные химические и физические свойства. Они могут выделять тепло при диссоциации, иметь высокую электропроводность и влиять на показатели кислотно-основного баланса раствора. Изучение и понимание свойств сильных электролитов существенно для многих областей науки, включая химию, физику и биологию.
Различия в поведении слабых и сильных электролитов в растворах

Слабые электролиты
- Слабые электролиты - это вещества, которые в растворе диссоциируют только частично. Они образуют небольшое количество ионов в растворе.
- Примеры слабых электролитов включают уксусную кислоту (CH3COOH), угольную кислоту (H2CO3) и аммонийную соль (NH4Cl).
- Слабые электролиты обычно представлены в реакциях с обратной стрелкой (\(\leftrightarrow\)), чтобы указать на их неполное растворение и обратимость процесса.
- Ионы, образующиеся при диссоциации слабых электролитов, остаются в растворе взаимодействовать с другими молекулами или ионами.
- Проводимость слабых электролитов в растворах намного ниже, чем у сильных электролитов, так как только небольшая часть молекул диссоциирует на ионы.
Сильные электролиты
- Сильные электролиты - это вещества, которые в растворе полностью диссоциируются, образуя большое количество ионов.
- Примеры сильных электролитов включают соль (NaCl), серную кислоту (H2SO4) и гидроксид натрия (NaOH).
- Сильные электролиты обычно представлены в реакциях с односторонней стрелкой (\( ightarrow\)), чтобы указать на полное растворение и отсутствие обратимости процесса.
- Полностью диссоциированные ионы сильных электролитов полностью разделяются в растворе и могут свободно взаимодействовать с другими молекулами или ионами.
- Проводимость сильных электролитов в растворах высокая, так как практически все молекулы диссоциируют на ионы.
Основное различие между слабыми и сильными электролитами заключается в степени диссоциации в растворах. Слабые электролиты диссоциируют только частично, тогда как сильные электролиты диссоциируют полностью. Это имеет прямое влияние на проводимость электрического тока в растворах, где сильные электролиты проводят ток гораздо лучше, чем слабые электролиты.
Практическое значение различия между слабыми и сильными электролитами
Различие между слабыми и сильными электролитами играет важную роль в различных областях науки и техники.
В химической аналитике знание о различиях между слабыми и сильными электролитами позволяет более точно определять концентрацию различных веществ в растворах. Для определения концентрации слабого электролита требуется учитывать его диссоциацию, а также зависимость диссоциации от концентрации. В случае с сильными электролитами данные о диссоциации уже известны и, следовательно, определение их концентрации становится проще и точнее.
В промышленности и научных исследованиях знание о различиях между слабыми и сильными электролитами помогает разрабатывать эффективные методы очистки и обеззараживания воды и других растворов. Например, для удаления загрязнений, связанных с наличием слабых электролитов, может потребоваться использование специальных методов очистки, в то время как для удаления сильных электролитов обычно достаточно стандартных методов, таких как фильтрация или электролиз.
Также различие между слабыми и сильными электролитами имеет практическое значение в медицине. Например, растворы слабых электролитов могут использоваться для увлажнения слизистых оболочек организма или для осуществления электролитного баланса. Сильные электролиты, в свою очередь, могут использоваться для проведения электролитной терапии или при реанимации.
Итак, практическое значение различия между слабыми и сильными электролитами несомненно важно в различных областях, от химической аналитики до медицины. Оно помогает более точно определять концентрацию веществ, разрабатывать эффективные методы очистки растворов и обеспечивать электролитный баланс в организмах.



