Эквивалентная масса вещества - одно из важных понятий в химии, используемое для определения количества реагирующих веществ и результатов химических реакций. Она позволяет нам установить соотношение между массой атомов или групп атомов вещества и количеством вещества, участвующего в химической реакции.
Определение эквивалентной массы основано на атомной массе элемента и его стехиометрическом числе, которое показывает, сколько частиц данного элемента участвует в реакции. Эта величина выражается в г/моль или в атомных единицах - атомных единицах массы (amu).
Применение эквивалентной массы в химии включает такие аспекты, как расчеты количества вещества, молекулярная масса, объемные расчеты и даже определение степени окисления. Величина эквивалентной массы позволяет установить соотношение между массой вещества и количеством вещества, что существенно упрощает химические расчеты и позволяет предсказывать результаты химических реакций.
Что такое эквивалентная масса?
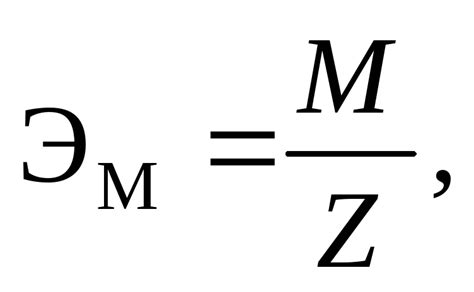
Эквивалентная масса является важным понятием в химии, так как она позволяет проводить расчеты массы вещества, участвующего в химических реакциях. Она используется для определения молярных пропорций реагентов и продуктов реакции.
Для определения эквивалентной массы необходимо знать химическую формулу вещества, его молярную массу и тип реакции, в которой оно участвует. Конечная формула для расчета эквивалентной массы может отличаться в зависимости от типа реакции.
Примеры:
- Для расчета эквивалентной массы кислоты, использованной в нейтрализационной реакции, необходимо знать массу данной кислоты, содержащую 1 моль водорода, а также массу 1 моль водорода. Это позволяет определить массу данной кислоты, эквивалентную массе водорода, и установить соответствующие пропорции при проведении фактической реакции.
- Для расчета эквивалентной массы металла в окислительно-восстановительной реакции используют соотношение между электрохимической эквивалентной массой и массой окисляемого или восстанавливаемого металла.
Знание эквивалентной массы вещества позволяет проводить точные и эффективные расчеты химических реакций, что является важным в химической промышленности и научных исследованиях.
Определение эквивалентной массы в химии

Эквивалентная масса обычно выражается в г/экв или моль/экв. Она зависит от того, с каким веществом реагирует данное вещество. Например, для реакций с водородом, эквивалентная масса равна массе вещества, деленной на его степень окисления.
Определение эквивалентной массы важно для решения задач, связанных с расчетом количества веществ, участвующих в реакциях. Это позволяет определить не только массу вещества, но и количество вещества в молях. Зная эквивалентную массу, можно также определить число эквивалентов вещества, что полезно при сравнении различных реагентов и расчете их эффективности в химических процессах.
Использование эквивалентной массы в химии позволяет проводить точные расчеты и предсказывать химические реакции. Этот понятие широко применяется в различных областях, таких как аналитическая химия, физическая химия и органическая химия.
Расчет эквивалентной массы вещества

Эквивалентная масса вещества представляет собой массу этого вещества, которая участвует в химических реакциях с заданной массой других веществ согласно их стехиометрическим коэффициентам.
В химии широко используется понятие "эквивалентная масса" для определения количества вещества, участвующего в реакции. Расчет эквивалентной массы вещества осуществляется с помощью формулы:
Эквивалентная масса = молекулярная масса / стехиометрический коэффициент
Для этого необходимо знать молекулярную массу вещества, которая определяется суммой атомных масс всех элементов, входящих в его состав. Степень окисления атомов также может влиять на расчет эквивалентной массы.
После определения молекулярной массы необходимо учесть стехиометрический коэффициент, который показывает соотношение между веществами в химической реакции. Он указывает, сколько молей данного вещества участвует в реакции.
Расчет эквивалентной массы вещества позволяет определить количество данного вещества, необходимого для проведения химической реакции на заданное количество других веществ.
Применение понятия эквивалентной массы позволяет проводить точные расчеты и определить оптимальные условия проведения реакции. Зная эквивалентную массу, можно также определить эквивалентное количество вещества и перевести его в моли или граммы.
Таким образом, расчет эквивалентной массы вещества является важным инструментом в химии и позволяет более точно оценивать количество вещества, участвующего в химической реакции.
Значение эквивалентной массы в химии

Для определенных типов реакций, таких как окислительно-восстановительные реакции, применяется понятие эквивалентного веса. Этот параметр используется для учета того факта, что разные вещества могут участвовать в реакции в разных молярных пропорциях, выраженных коэффициентами стехиометрии.
Значение эквивалентной массы в химии может быть вычислено с использованием массы вещества и его молярной массы. Обычно эквивалентная масса выражается в граммах на эквивалент. Например, эквивалентная масса водорода равна массе одного моля водорода (1 г) и используется для вычисления количества вещества в реакции с участием водорода.
Значение эквивалентной массы может быть полезным при решении химических задач, таких как расчеты количества реагентов и продуктов, анализ состава химических соединений и понимание механизмов химических реакций. Оно помогает определить соотношения между различными компонентами в реакции и понять, какие они играют роли в превращении.
Важно отметить, что значение эквивалентной массы зависит от конкретной реакции или превращения, и оно может быть разным для разных веществ. Поэтому при решении задач необходимо учитывать специфику реакции и правильно выбирать соответствующие значения эквивалентной массы для каждого вещества.
Применение эквивалентной массы в химических реакциях

Эквивалентная масса вещества играет важную роль при расчете химических реакций. Она позволяет определить пропорции, в которых реагенты вступают в реакцию и образуют продукты.
Зная эквивалентную массу вещества, можно сравнивать массы различных веществ и определять, какую массу одного вещества необходимо использовать, чтобы реагировать с определенным количеством другого вещества.
Эквивалентная масса выражается в г/экв и обычно определяется относительно массы водорода или кислорода. Это позволяет привязать эквивалентную массу к относительной атомной массе вещества.
Применение эквивалентной массы в химических реакциях позволяет напрямую сравнивать количества молекул разных веществ, таких как ионы, атомы, молекулы. Она используется при расчете количества реагентов, рассчете выхода продуктов, и определении степени окисления и восстановления веществ в реакции.
Роль эквивалентной массы в определении концентрации вещества

Эквивалентная масса вещества играет важную роль в определении его концентрации. Концентрация вещества позволяет оценить количество данного компонента в растворе или смеси.
Для определения концентрации вещества необходимо знать его эквивалентную массу. Эквивалентная масса представляет собой массу вещества, соответствующую одной молекуле реагента или реагирующей единице компонента. Таким образом, эквивалентная масса является массой вещества, соответствующей одному эквиваленту атомов или ионов.
С использованием эквивалентной массы можно провести расчеты для определения концентрации вещества в растворе. Для этого необходимо знать массу данного компонента в растворе и объем раствора. Рассчитывается количество вещества в эквивалентах, а затем определяется концентрация вещества в растворе.
Например, рассмотрим раствор соляной кислоты (HCl), в котором известна масса кислоты (1 г) и объем раствора (1 л). Для расчета концентрации необходимо знать эквивалентную массу HCl. Допустим, эквивалентная масса HCl равна 36,5 г/экв. Тогда можно вычислить количество HCl в эквивалентах: 1 г / 36,5 г/экв = 0,0274 экв. Далее, рассчитываем концентрацию HCl в растворе: 0,0274 экв / 1 л = 0,0274 Н. Результирующая концентрация соляной кислоты в данном растворе составит 0,0274 Н.
Таким образом, использование эквивалентной массы вещества позволяет определить его концентрацию в растворе или смеси. Это важный показатель, используемый в химических исследованиях и производстве различных веществ.



