Химическая связь - это фундаментальное понятие в химии, которое описывает способ, которым атомы образуют химические соединения. Тип химической связи определяет, какие атомы и с какой силой связаны в молекуле. В зависимости от типа связи, молекула может иметь различные физические и химические свойства.
Существует три основных типа химической связи: ионная связь, ковалентная связь и металлическая связь. Каждый из этих типов связей обладает уникальными характеристиками и влияет на структуру и свойства соединений, которые они образуют.
Ионная связь возникает из-за притяжения противоположно заряженных ионов. В этом типе связи происходит передача электронов от одного атома к другому. Ковалентная связь, с другой стороны, образуется, когда атомы делят пару электронов между собой. Металлическая связь происходит между атомами металлов и характеризуется общими или свободными электронами, которые могут перемещаться между атомами.
Типы химической связи: ионная, ковалентная, металлическая
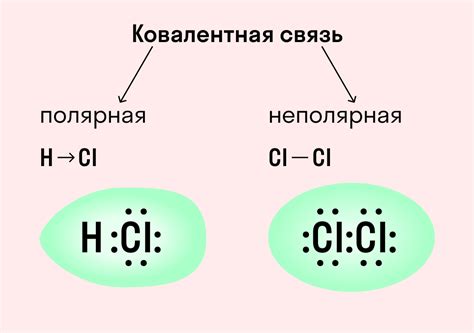
Ковалентная связь - тип химической связи, в которой электроны внешних оболочек атомов образующих молекулу, располагаются в общих межатомных областях. Ковалентные связи создаются между неметаллами и включают обмен или совместное использование электронов. Создавая молекулу, эти связи образуют сильные взаимодействия и определяют большинство свойств веществ.
Металлическая связь - тип химической связи, который встречается в металлах. Здесь электроны внешней оболочки атомов металла образуют общую электронную облако, которое связывает атомы между собой. Электроны в металлической связи могут свободно перемещаться внутри кристаллической структуры металла и обеспечивать его электрическую проводимость и термическую кондуктивность.
Основные характеристики ионной связи
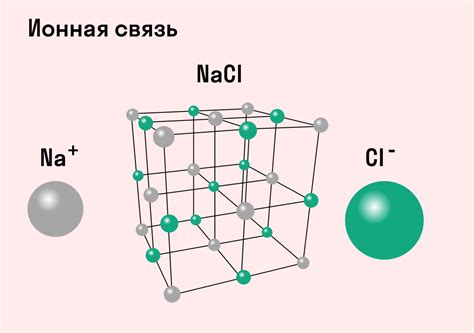
Важные характеристики ионной связи:
| Свойство | Описание |
|---|---|
| Заряд ионов | В ионной связи образуются положительно и отрицательно заряженные ионы. Ионы металлов имеют положительный заряд, а ионы неметаллов - отрицательный. |
| Сила связи | Ионная связь обладает очень большой силой, поэтому соединения с ионной связью обычно обладают высокой температурой плавления и кипения. |
| Кристаллическая структура | Ионные соединения образуют кристаллическую структуру, в которой ионы упорядочены по особым правилам. В результате образуется решетка, которая придает соединению его характерные физические свойства. |
| Проводимость | Твердые ионные соединения обладают плохой проводимостью электрического тока. Однако, в расплавленном или растворенном состоянии (в виде электролитов), они могут быть проводниками электричества. |
Ионная связь широко распространена в природе и важна для понимания ряда процессов и явлений, как в химии, так и в других науках.
Ковалентная связь и ее свойства

Главной особенностью ковалентной связи является равное распределение электронов между атомами, что позволяет образовывать стабильные молекулы. При этом оба атома обогащают свою электронную оболочку, достигая наиболее стабильного состояния – наполнения внешнего энергетического уровня.
Ковалентная связь обладает следующими свойствами:
- Силу ковалентной связи определяют энергетические характеристики связующих электронных пар и величина их перекрытия;
- Энергия ковалентной связи может быть разная и зависит от типа связи и вида вещества;
- Ковалентная связь может быть полярной или неполярной, в зависимости от разности электроотрицательностей атомов;
- Ковалентная связь обычно характеризуется определенной длиной и направленностью, что связано с распределением электронов в пространстве.
Металлическая связь: особенности и свойства

Особенностью металлической связи является то, что электроны в металле могут свободно передвигаться между атомами. В отличие от других типов связи, таких как ионная или ковалентная, электроны в металлической связи не принадлежат конкретным атомам, а образуют так называемое "электронное облако".
Металлическая связь обладает несколькими особыми свойствами:
- Проводимость электричества и тепла. Благодаря свободному движению электронов, металлы обладают высокой проводимостью как электрического тока, так и тепла. Это свойство находит широкое применение в различных отраслях, таких как электротехника и металлообработка.
- Пластичность и хорошая деформируемость. Из-за отсутствия жесткой связи между атомами, металлы обладают способностью к пластической деформации. Это позволяет им быть хорошими материалами для изготовления различных изделий, например, проволоки или листового металла.
- Металлический блеск. Металлы обладают характерным блеском, который связан с отражением света от свободно движущихся электронов в металле.
- Высокая плотность и твердость. Металлы обычно обладают высокой плотностью и твердостью, что делает их прочными и стойкими к механическим нагрузкам.
Металлическая связь является одной из основных форм связи в химии и играет важную роль в различных аспектах нашей жизни, от производства металлических изделий до разработки новых материалов и технологий.
Различия между типами химической связи
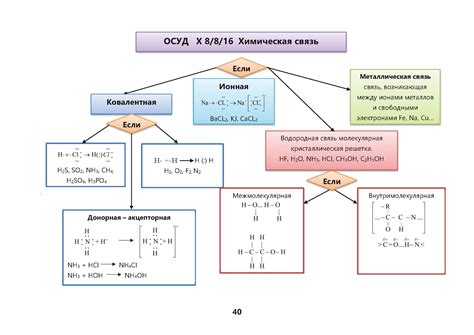
Ковалентная связь: Это тип химической связи, образующейся путем общего использования электронов между атомами. В отличие от ионной связи, ковалентная связь происходит между неметаллами. Она является сильной и олицетворяет собой совместное использование электронов во внешней оболочке атомов, чтобы достичь стабильности.
Металлическая связь: Это тип химической связи, которая возникает между металлическими атомами в кристаллической решетке. Главной особенностью металлической связи является общее использование свободных электронов между атомами. Металлическая связь является сильной и отвечает за электропроводность и металлические свойства металлов.
Водородная связь: Это тип слабой химической связи, которая возникает между атомами водорода и электронно-отрицательными атомами (такими как кислород или азот). Этот тип связи является слабым и обычно происходит между молекулами. Водородная связь играет важную роль во многих биологических процессах, таких как образование ДНК и белковой структуры.
Ван-дер-Ваальсова связь: Это тип слабой химической связи, которая возникает между атомами или молекулами, когда их электронные оболочки временно образуют диполь или момент магнитного момента. Этот тип связи является слабым и отвечает за различные свойства, такие как сжимаемость газов и вязкость жидкостей.
Важность понимания типов химической связи

В химии существуют три основных типа химической связи: ионная, ковалентная и металлическая. Каждый из этих типов имеет свои уникальные характеристики и свойства.
| Тип связи | Описание | Примеры соединений |
|---|---|---|
| Ионная связь | Связь между атомами, образующаяся за счет притяжения противоположно заряженных ионов. Характеризуется передачей электронов от одного атома к другому. | NaCl (хлорид натрия), MgO (оксид магния) |
| Ковалентная связь | Связь, основанная на совместном использовании электронов. Атомы делят свои валентные электроны, чтобы образовать общую область электронной плотности. | H2O (вода), CO2 (диоксид углерода) |
| Металлическая связь | Связь между металлическими атомами, основанная на обмене и передвижении электронов в металлической решетке. Характеризуется высокой электропроводностью и пластичностью. | Fe (железо), Cu (медь) |
Знание типов химической связи позволяет предсказывать физические и химические свойства веществ. Например, ионные соединения обычно имеют высокие температуры плавления и кипения, а также хорошую растворимость в воде из-за сильного притяжения между ионами. Ковалентные соединения могут быть газами, жидкостями или твердыми веществами с низкими температурами плавления и кипения, а также обычно имеют низкую растворимость в воде. Металлические соединения обладают хорошей электропроводностью и могут образовывать кристаллические решетки.
Таким образом, понимание типов химической связи помогает ученым предсказывать свойства и поведение веществ, что имеет огромное значение в различных областях химии и промышленности.



