Химические реакции являются основой для понимания процессов, происходящих в мире вокруг нас. Каждый раз, когда происходит химическая реакция, происходят изменения в молекулах и атомах, приводящие к образованию новых веществ или превращению существующих. Химические реакции играют важную роль во многих отраслях науки, промышленности и повседневной жизни.
В химической реакции участвуют реагенты, которые являются исходными веществами, и продукты, которые образуются в результате реакции. Реагенты могут быть различными веществами: элементами, соединениями или их смесями. Продукты реакции могут быть новыми соединениями или измененными веществами, которые обладают другими свойствами.
Химические реакции подчиняются определенным законам, которые определены правилами сохранения массы, энергии и других физических величин. При химической реакции происходит перестройка химических связей между атомами веществ, что ведет к изменению их структуры и свойств. Некоторые реакции могут быть экзотермическими и выделять тепло, в то время как другие реакции являются эндотермическими и поглощают энергию.
Химические реакции могут происходить под влиянием различных факторов, таких как температура, давление, концентрация реагентов и наличие катализаторов. Изучение и понимание химических реакций является важной задачей химии и помогает нам развивать новые материалы, лекарства и технологии. Без химических реакций было бы невозможно понять и управлять многими процессами и явлениями в нашей жизни.
Реактивы и продукты
Реактивы и продукты выражаются с помощью химических формул. Химическая формула реактивов указывает, из каких веществ они состоят, а формула продуктов - какие новые вещества получаются в результате реакции.
Во время химической реакции происходят изменения в атомной или молекулярной структуре реагентов, что приводит к образованию новых связей и образованию продуктов. Количество реагентов и продуктов может быть различным, и оно определяется согласно закону сохранения массы.
Реактивы и продукты могут быть газообразными, жидкими или твердыми веществами, в зависимости от конкретной химической реакции. Они могут иметь разные свойства, такие как цвет, запах или растворимость.
Изучение реактивов и продуктов позволяет химикам понять, как происходят химические реакции, какие вещества могут взаимодействовать, и какие новые соединения могут быть синтезированы.
Энергия реакции
В ходе химической реакции происходят изменения связей между атомами в молекулах веществ. Для образования и разрушения связей требуется энергия. Если в реакции энергия поглощается, то говорят о ее эндотермичности. В этом случае энергия реакции является положительной величиной. Если же в реакции выделяется энергия, она считается экзотермической. В этом случае энергия реакции является отрицательной величиной.
Энергия реакции влияет на скорость и направление химической превращения веществ. Если энергия реакции положительна, то ее совершение требует внешнего источника энергии. В случае, когда энергия реакции отрицательна, реакция происходит самопроизвольно.
Существуют различные способы изменения энергии реакции. Например, с помощью катализаторов можно снизить энергию активации реакции, что ускоряет химическое превращение. Также, изменение условий реакции, таких как температура или концентрация реагентов, может влиять на энергию реакции.
Знание энергии реакции позволяет управлять химическими процессами, оптимизировать их условия и получать нужные продукты с максимальной эффективностью. Поэтому изучение энергетики химических реакций является важной задачей в химии.
Изменение состояния веществ

Химическая реакция может привести к изменению состояния вещества, которое может быть твердым, жидким или газообразным. В результате реакции вещества могут претерпевать изменение структуры и свойств, что приводит к образованию новых веществ.
Например, при нагревании твердого вещества оно может переходить в жидкое состояние, а затем в газообразное. Это называется плавлением и испарением. Обратные процессы - конденсация и кристаллизация - могут привести к образованию твердого вещества из жидкого или газообразного состояния.
В химических реакциях также может происходить образование растворов, в которых твердое или газообразное вещество растворяется в жидкости. При этом происходят химические взаимодействия между компонентами раствора, что может вызывать изменения его цвета, запаха или вкуса.
Изменение состояния вещества в химической реакции имеет большое значение для многих технологических процессов. Например, при синтезе лекарственных препаратов или производстве материалов, необходимо контролировать и управлять изменениями состояния вещества для достижения желаемых результатов.
Скорость реакции
Существует несколько факторов, которые могут влиять на скорость химической реакции:
- Концентрация реагентов. Чем выше концентрация реагентов, тем больше вероятность столкновения частиц и, следовательно, больше скорость реакции.
- Температура. Повышение температуры обычно увеличивает скорость реакции, так как это приводит к увеличению энергии столкновений и частоты реакций.
- Поверхность контакта. Чем больше поверхность контакта, тем больше места для столкновения молекул и, следовательно, больше скорость реакции.
- Катализаторы. Катализаторы могут ускорить химическую реакцию, уменьшая энергию активации и увеличивая частоту столкновений.
Скорость реакции может быть характеризована как изменение концентрации реактантов или продуктов в единицу времени. Она может быть выражена в разных единицах, например в молях на литр в секунду или в граммах на минуту.
Изучение и понимание скорости реакции важно не только для науки, но и для многих практических приложений. Это позволяет оптимизировать процессы производства, разработать новые материалы и лекарства, а также понять, как происходят химические реакции в нашей жизни.
Катализаторы и ингибиторы

Катализаторы и ингибиторы играют важную роль в химических реакциях, регулируя скорость и направление превращений веществ.
Катализаторы – это вещества, которые ускоряют химическую реакцию, не расходуясь при этом полностью. Они снижают энергию активации, необходимую для начала реакции, и повышают вероятность столкновения реагирующих частиц. Катализаторы могут быть различных типов: гомогенные, когда катализатор и реагенты находятся в одной фазе, и гетерогенные, когда реагенты и катализатор находятся в разных фазах.
Примеры катализаторов включают металлы, оксиды, кислоты, основания, ферменты и другие вещества. Катализаторы могут быть природными или искусственными, и они играют важную роль в различных процессах, от производства лекарств до очистки воды.
Ингибиторы, напротив, замедляют или предотвращают химическую реакцию. Они могут подавлять активность катализатора или препятствовать взаимодействию реагентов. Ингибиторы могут быть используемыми или натуральными. Они часто используются для контроля скорости реакции или защиты от нежелательных превращений.
Для наглядности, можно представить информацию в таблице.
| Тип | Примеры | Характеристики |
|---|---|---|
| Катализаторы | Металлы, оксиды, кислоты, основания, ферменты | Ускоряют реакцию, не расходуются полностью |
| Ингибиторы | Фосфорное соединение, сульфит натрия, нитрит натрия | Замедляют или предотвращают реакцию |
Типы химических реакций
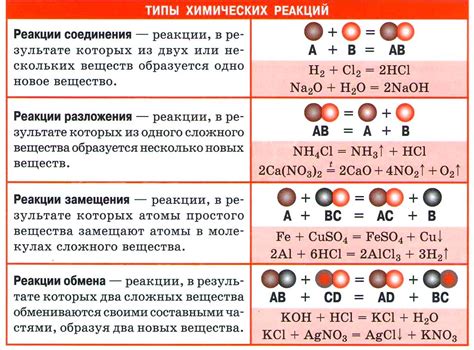
Химические реакции могут быть различными и классифицируются в зависимости от разных критериев. Рассмотрим основные типы химических реакций:
Синтез - это реакция, в которой из более простых веществ образуется более сложное вещество. Примером является реакция синтеза между натрием и хлором, при которой образуется хлорид натрия:
2Na + Cl2 → 2NaCl
Распад - это реакция, обратная синтезу. В этом типе реакции сложное вещество распадается на более простые компоненты. Например, распад воды на водород и кислород:
2H2O → 2H2 + O2
Замещение - это реакция, при которой одно атом или группа атомов замещаются другими атомами или группами атомов. Реакция замещения может быть однозначной или двухсторонней. Примером является реакция замещения между железом и медью:
Fe + CuSO4 → FeSO4 + Cu
Окислительно-восстановительная (редокс-реакция) - это реакция, при которой происходит передача электронов от одного вещества к другому. Один компонент окисляется, то есть теряет электроны, а другой восстанавливается, то есть получает электроны. Примером является реакция между железом и кислородом:
4Fe + 3O2 → 2Fe2O3
Кислотно-щелочная - это реакция, которая происходит между кислотами и щелочами, образуя соль и воду. Примером является реакция между соляной кислотой и гидроксидом натрия:
HCl + NaOH → NaCl + H2O
Гидролиз - это реакция, которая происходит при взаимодействии веществ с водой, приводящая к образованию кислот или щелочей. Например, гидролиз соли аммония:
NH4Cl + H2O → NH4OH + HCl
Это лишь некоторые из типов химических реакций. Они могут комбинироваться и протекать одновременно, образуя более сложные процессы в мире химии.
Балансировка уравнений

Чтобы сбалансировать уравнение, необходимо изменять коэффициенты перед химическими формулами, указывающие на количество молекул или атомов каждого вещества. При этом соблюдается закон сохранения массы: сумма масс атомов на левой стороне уравнения равна сумме масс атомов на правой стороне.
Балансировка уравнений осуществляется путем последовательного изменения коэффициентов и проверки соблюдения условий балансировки. При этом следует помнить, что нельзя изменять формулы химических соединений и количество элементов внутри них.
Балансировка может быть сложной задачей, особенно при наличии большого количества элементов и химических соединений в уравнении. Однако, она необходима для точного описания химической реакции и расчетов связанных с данным процессом.
После балансировки уравнения, оно становится полностью выполненным и отображает правильное соотношение между реагентами и продуктами химической реакции.
Применение химических реакций

Химические реакции имеют широкое применение и играют важную роль в различных областях нашей жизни. Ниже приведены некоторые примеры применения химических реакций:
- Производство пищевых продуктов: химические реакции используются при приготовлении различных видов пищи, включая выпечку, жарку, варку и соление. Реакции ферментации, окисления и взаимодействия различных химических компонентов позволяют создавать разнообразные вкусы и текстуры пищевых продуктов.
- Производство лекарств: многие лекарственные препараты производятся с помощью химических реакций. Химические реакции могут использоваться для синтеза активных компонентов, а также для улучшения их стабильности и биодоступности.
- Производство материалов: многие материалы, такие как пластик, стекло и металлы, производятся с использованием химических реакций. Реакции полимеризации, окисления и редукции могут менять структуру и свойства материалов, делая их подходящими для различных приложений.
- Очистка воды и воздуха: химические реакции могут использоваться для удаления загрязнений из воды и воздуха. Например, воду можно очистить путем применения реакций флокуляции, фильтрации и окисления, которые помогают удалять загрязняющие вещества.
- Производство энергии: реакции сгорания используются для производства энергии в различных формах, включая тепло и электричество. Например, реакции сгорания при сжигании угля или нефти могут использоваться для преобразования химической энергии в электрическую энергию.
Это лишь некоторые примеры применения химических реакций. Химические реакции имеют огромную значимость в нашей жизни и используются во множестве других областей, включая производство тканей, косметики, автомобилей и многих других.



