Нх4Сл - химическое соединение, которое принадлежит к классу солей. Его формула указывает на наличие атомов азота (N) и водорода (H), а также катионов аммония (NH4+). Следовательно, Нх4Сл можно также найти как NH4Cl, где Cl обозначает хлоридный ион. Хлорид аммония - наиболее распространенное название этого соединения.
Хлорид аммония обладает рядом интересных свойств, которые делают его полезным в различных областях. Во-первых, он обладает низкой температурой плавления и может легко переходить из твердого состояния в газообразное при нагревании без образования жидкой фазы. Это свойство делает хлорид аммония полезным в процессе сублимации, используемом для получения чистых веществ.
Хлорид аммония также широко используется в медицине, фармацевтике и косметической промышленности. Он может быть применен в качестве вяжущего компонента, антисептика, ополаскивателя для полости рта и других препаратов. Благодаря своим свойствам, хлорид аммония может быть использован для обезболивания и снижения зуда, а также для нейтрализации бактерий и грибков.
Нх4Сл - что это за вещество в химии?
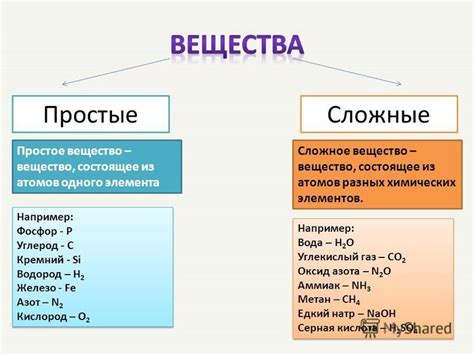
Общая формула аммонийных солей может быть представлена как NH4X, где X - анион, который может быть хлоридом (NH4Cl), сульфатом (NH42SO4) или другими соединениями. Аммоний соль характеризуется высокой растворимостью в воде и обладает особыми свойствами, которые часто используются в химических процессах и промышленности.
| Название | Химическая формула | Примеры |
|---|---|---|
| Аммоний хлорид | NH4Cl | Соли расширения металла, электролитические растворы |
| Аммоний сульфат | (NH4)2SO4 | Удобрения, кровяная мука |
| Аммоний нитрат | NH4NO3 | Удобрения, пиротехника |
Аммонийные соли широко используются в химической, сельскохозяйственной и медицинской отраслях. Они могут быть использованы в качестве источников азота и питательных веществ для растений, катализаторов в химических реакциях, а также в производстве лекарственных препаратов. Будучи химическими соединениями, аммонийные соли могут быть опасными и требуют особой осторожности при использовании и хранении.
Состав и структура вещества Нх4Сл
Структура молекулы Нх4Сл представляет собой аммонийный ион (Нх4+), в котором атом водорода замещает один из атомов серы из иона серы (Сл2-). Такая структура обусловливает особенности свойств вещества Нх4Сл.
Вещество Нх4Сл хорошо растворимо в воде и образует кристаллы, которые могут быть цветными или бесцветными в зависимости от примесей. Оно обладает кислотными свойствами и участвует во многих реакциях.
Известно несколько разновидностей вещества Нх4Сл, включая аммоний сульфат ((NH4)2SO4) и аммоний сульфид (NH4)2S. Они также обладают схожими свойствами и находят широкое применение в различных областях, включая химическую промышленность, сельское хозяйство и медицину.
Физические свойства Нх4Сл

Нх4Сл представляет собой химическое соединение из группы солей, состоящее из катионов аммония (NH4+) и анионов хлорида (Cl-). Это белый кристаллический порошок или кристаллы с сольным вкусом.
Нх4Сл очень хорошо растворим в воде и может образовывать гигроскопичные растворы, которые легко абсорбируют влагу из окружающей среды. Это свойство делает его полезным в качестве сушащего агента и осушителя в различных процессах.
При нагревании Нх4Сл происходит его дезинтеграция, при этом образуются пары аммония и хлоридов. Вещество также может подвергаться термическому разложению при высоких температурах.
Физические свойства Нх4Сл могут быть изменены добавлением различных примесей или изменением условий синтеза. Вещество также может образовывать разные кристаллические формы, в зависимости от метода синтеза и температуры.
Нх4Сл имеет высокую плотность и температуру плавления, что делает его полезным в различных областях, включая химическую промышленность, фармацевтику и лабораторные исследования.
Химические свойства Нх4Сл

При нагревании Нх4Сл происходит его разложение на аммиак (Н3) и хлороводород (HCl) газы. Этот процесс называется термическим распадом. Реакция может быть описана следующим образом:
2NH4Cl → 2NH3 + H2 + Cl2
Нх4Сл часто используется в лабораториях для проведения различных химических исследований. Он также может использоваться в медицинских препаратах, в промышленности и в сельском хозяйстве.
Когда Нх4Сл растворяется в воде, происходит эндотермическая реакция, сопровождающаяся поглощением тепла. Это делает его полезным в некоторых приложениях, таких как охлаждение или замораживание.
Нх4Сл также может образовать две различных формы кристаллической решетки - ромбическую и кубическую. Ромбическая соль более устойчива при низких температурах, а кубическая соль более стабильна при повышенных температурах.
Применение Нх4Сл в промышленности
Основные области применения Нх4Сл в промышленности:
- Удобрения: Нх4Сл является одним из наиболее популярных и широко используемых азотных удобрений. В сельском хозяйстве она применяется для повышения плодородия почвы и увеличения урожайности различных культур.
- Производство взрывчатых веществ: Нх4Сл служит основным источником азота при производстве ряда взрывчатых веществ, включая тротил и нитроглицерин. Она обеспечивает необходимый источник азота для реакции и способствует стабильности процесса.
- Производство красителей: Нх4Сл используется в качестве реагента в процессе производства различных красителей. Она способствует синтезу определенных пигментов и является важным компонентом при создании разнообразных оттенков.
- Отражение света: Нх4Сл применяется в фотографии и печати для получения качественных отпечатков. Отражая свет, она обеспечивает яркость цветов и улучшает контрастность изображений.
- Огнетушители: Нх4Сл используется в некоторых типах огнетушителей, так как обладает способностью подавлять пламя и охлаждать горящее вещество.
В целом, Нх4Сл играет важную роль в промышленности и находит применение во множестве отраслей, включая сельское хозяйство, химическую промышленность, фотографию и др.
Опасность использования Нх4Сл

При контакте с кожей Нх4Сл может вызывать раздражение и опасный химический ожог. Поэтому при работе с этим веществом рекомендуется использовать защитные перчатки, предотвращать попадание на кожу и немедленно промыть место контакта водой.
Вдыхание паров Нх4Сл может вызвать раздражение дыхательных путей, а в некоторых случаях - ожоги легких. Поэтому при работе с этим веществом необходимо обеспечить хорошую вентиляцию помещения и использовать респираторы или маски для защиты дыхательной системы.
Смешивание Нх4Сл с другими химическими веществами, такими как щелочи или кислоты, может вызвать опасные химические реакции и образование токсичных газов. Поэтому необходимо тщательно изучить совместимость Нх4Сл с другими веществами и следовать инструкциям по безопасности.
| Опасность | Описание |
|---|---|
| Веселье | Нх4Сл может вызывать эйфорию и возбуждение при случайном контакте с кожей или дыхательными путями. |
| Отравление | При проглатывании Нх4Сл может вызвать острую отравление, симптомы которого включают тошноту, рвоту, головокружение и нарушение дыхания. |
| Пожароопасность | Нх4Сл является горючим веществом и может поддерживать горение. При пожаре с Нх4Сл необходимо использовать подходящие огнетушители или пены. |
Методы получения Нх4Сл
Существует несколько методов получения Нх4Сл (аммоний сульфата), которые применяются в химической промышленности и лабораторной практике.
- Прямая реакция. Один из способов получения Нх4Сл - это реакция аммиака (NH3) с серной кислотой (H2SO4). Реакция происходит при нагревании и приводит к образованию Нх4Сл.
- Ионный обмен. Другой метод получения Нх4Сл - это ионный обмен, при котором аммонийные ионы (NH4+) обмениваются с положительно заряженными ионами другого вещества. Например, аммонийные ионы могут замещать металлические ионы в растворе сульфата.
- Окислительно-восстановительная реакция. Некоторые методы получения Нх4Сл основаны на окислительно-восстановительных реакциях. Например, аммиак (NH3) может быть окислен до азота (N2) с помощью кислорода (O2), а затем полученный азот может реагировать с водой (H2O) и давать Нх4Сл.
Выбор метода зависит от доступности исходных реагентов, требуемого количества Нх4Сл и других факторов.



