Кислород - это неметалл, обладающий уникальными химическими свойствами. Однако, по сравнению с металлами, его неметаллические свойства обычно являются более слабыми и менее выраженными. Суть этого наблюдения заключается в том, что кислород не обладает способностью проводить электрический ток, как это делают металлы, и его химическая активность ограничена.
Одно из основных неметаллических свойств кислорода - это его химическая реактивность. Кислород является одним из самых активных элементов в таблице Менделеева и образует множество соединений с другими элементами. Однако, его реактивность может сравнительно незначительно по сравнению с реактивностью металлов, которые способны вступать в химическую реакцию с большим количеством элементов и соединений.
Еще одно слабое неметаллическое свойство кислорода - это его низкая теплопроводность. В отличие от металлов, которые являются отличными проводниками тепла, кислород плохо проводит тепло. Это объясняется строением его атома, в котором отсутствуют свободные электроны, необходимые для передачи тепловой энергии.
Слабое проявление неметаллических свойств кислорода
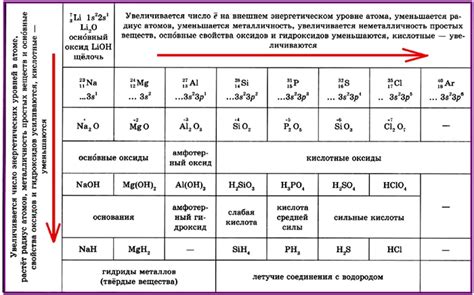
В отличие от металлов, кислород проявляет свои неметаллические свойства относительно слабо.
Кислород обладает химической активностью, но ее степень ограничена по сравнению с другими неметаллами, такими как фтор и хлор.
Основным свойством кислорода является его способность вступать в реакции окисления, образуя оксиды с различными элементами. Но даже в реакциях окисления кислород не проявляет такую выраженную активность, как, например, хлор, который может реагировать с многими веществами, в том числе с металлами.
| Свойства | Кислород | Хлор |
| Вступает в реакции окисления | Да | Да |
| Реакция с металлами | Ограниченная | Более активная |
| Образование специфических соединений | Возможно, но в меньшем количестве | Да, в большем количестве |
Таким образом, кислород, хоть и является неметаллом, проявляет свои характерные неметаллические свойства относительно слабо по сравнению с более активными неметаллами, такими как хлор.
Роль кислорода в химических реакциях

Кислород является сильным окислителем, способным выступать в реакциях окисления, взаимодействуя с другими веществами и отдающие электроны, благодаря высокой электроотрицательности. Возможность кислорода образовывать двухатомные молекулы O2 делает его основной источник реактивных кислородных видов, таких как одноатомная кислородная смесь и пары кислорода.
Кислород является необходимым компонентом для многих процессов сгорания, включая дыхание в живых организмах. Он горит в оксидирующих реакциях практически со всеми веществами, приводя к образованию оксидов. При этом кислород выступает в роли активного окислителя, способного интенсивно реагировать с металлами, неметаллами и соединениями обоих типов.
Кислород также обладает способностью образовывать кислоты. В реакциях с некоторыми элементами он может образовывать кислородные кислоты, которые являются основой бескислородных кислот.
Роль кислорода в химических реакциях трудно переоценить, поскольку он является неотъемлемым компонентом многих жизненно важных процессов и реакций, происходящих в природе и промышленности.
Определение неметаллических и металлических свойств

Кислород – один из самых известных неметаллов. Он имеет множество неметаллических свойств, что делает его незаменимым элементом для поддержания жизни на Земле. Кислород является непрозрачным, безвкусным и беззапаховым газом при комнатной температуре и давлении.
Металлы – это вещества, обладающие определенными физическими и химическими свойствами, которые отличают их от неметаллов. Они обычно обладают высокой электропроводностью и теплопроводностью, а также формируют положительно заряженные ионы в реакциях с другими веществами.
Примеры металлов включают железо, алюминий, медь и золото. Они обладают блестящим металлическим блеском и хорошо проводят тепло и электричество. Металлы обычно обладают высокой пластичностью и могут быть легко прокованы и растянуты без разрушения.
Неметаллические свойства кислорода

Кислород относится к группе неметаллов и обладает различными неметаллическими свойствами. Однако, по сравнению с некоторыми другими неметаллами, его неметаллические свойства выражены достаточно слабо.
Одной из основных неметаллических свойств кислорода является его способность к окислительным реакциям. Кислород легко взаимодействует с другими элементами, образуя оксиды. Например, при взаимодействии с металлами образуются металлические оксиды, а с неметаллами - неметаллические оксиды.
| Свойство | Описание |
|---|---|
| Реакция с металлами | Кислород образует металлические оксиды при взаимодействии с металлами. |
| Реакция с неметаллами | При взаимодействии с неметаллами образуются неметаллические оксиды. |
| Окислительные свойства | Кислород проявляет сильные окислительные свойства и может окислять другие вещества. |
| Недолго жизнеспособны в воздухе | Кислород не может длительное время существовать в свободной форме в атмосфере, поэтому обычно находится в соединениях, таких как вода или оксиды. |
| Обладает кислотными свойствами | Кислород может образовывать кислоты при взаимодействии с различными элементами. |
Несмотря на относительную слабость неметаллических свойств кислорода по сравнению с металлами и некоторыми другими неметаллами, они играют важную роль во многих физических и химических процессах.
Кислород как окислитель

Когда кислород взаимодействует с другими элементами, особенно с металлами, он может вызывать окисление, что означает потерю электронов. Это происходит благодаря высокой электроотрицательности кислорода, которая позволяет ему эффективно вытягивать электроны из других атомов.
Взаимодействие кислорода с металлами может привести к образованию окисей, которые обладают различными физическими и химическими свойствами. Часто окиси металлов образуют пленки или слои на поверхности металла, которые могут защищать его от дальнейшего окисления.
Кислород также проявляет свои окислительные свойства при взаимодействии с неорганическими и органическими веществами. Например, многие органические соединения могут гореть в присутствии кислорода, образуя окись углерода и воду. Это свойство кислорода используется в процессе сжигания топлива для получения энергии.
Таким образом, кислород обладает высокой окислительной активностью, которая позволяет ему взаимодействовать с другими веществами и участвовать во многих важных химических реакциях.
Одноатомный кислород и его реактивность

Кислород является одним из наиболее распространенных элементов на Земле и составляет до 21% атмосферы. Однако в природе встречается в основном в виде соединений, таких как вода, оксиды и карбонаты.
Одноатомный кислород обладает несколькими основными свойствами:
- Высокая окислительная способность: Кислород является одним из сильнейших окислителей в химии. Он может вступать в реакции с другими веществами, передавая им электроны и при этом сам восстанавливаясь. Эта способность кислорода играет важную роль во многих химических процессах, включая горение, дыхание и окислительные реакции в организмах.
- Способность к образованию соединений: Одноатомный кислород образует множество различных соединений. Наиболее известными из них являются оксиды кислорода, такие как диоксид углерода (CO2) и оксид азота (NO2), которые играют важную роль в климатических изменениях и загрязнении воздуха.
- Кислородная активность: Кислород может вступать в химические реакции с различными элементами и соединениями. Это свойство обусловлено его высокой электроотрицательностью. Кислород может образовывать сильные химические связи с другими элементами, что делает его важным компонентом большого числа органических и неорганических соединений.
Физические свойства кислорода
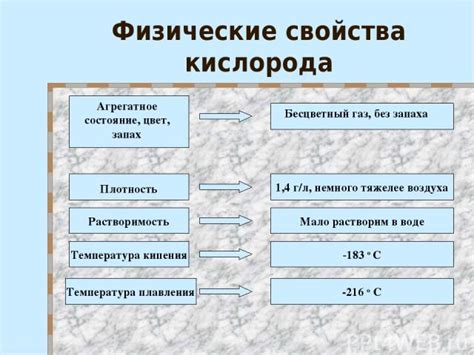
| Физическое свойство | Описание |
|---|---|
| Агрегатное состояние | Кислород является газообразным в нормальных условиях температуры и давления. Он не имеет специфического цвета и запаха. |
| Температура плавления | Кислород плавится при температуре -218,79°C (-361,82°F). При этой точке он превращается из газообразного состояния в жидкое. |
| Температура кипения | Кислород кипит при температуре -183,0°C (-297,4°F). При этой точке он превращается из жидкости в газообразное состояние. |
| Плотность | Плотность кислорода при нормальных условиях составляет примерно 1,429 г/л. |
| Растворимость | Кислород слабо растворим в воде. Но он может быть растворен в других жидкостях, таких как нефть. |
Эти физические свойства кислорода играют важную роль в различных процессах, как в природных, так и в промышленных. Например, его растворимость в воде позволяет кислороду распространяться в океанах и предоставлять жизненную среду для морских организмов.
Неметаллический кислород и его влияние на окружающую среду

Около 21% атмосферного воздуха составляет кислород, и он играет важную роль в дыхании живых существ. Он используется для взаимодействия с пищевыми веществами и создания энергии. Животные и люди вдыхают кислород и выделяют углекислый газ (СО2) в качестве побочного продукта. Другие организмы, такие как растения, производят кислород во время процесса фотосинтеза, поглощая углекислый газ.
Однако, кислород также может нанести вред окружающей среде. Его реактивность может вызывать окисление и коррозию различных материалов. Кислород также является ключевым фактором в процессе окисления и разложения органических веществ, что может приводить к образованию загрязняющих веществ в атмосфере.
Кислород играет важную роль в формировании озона в стратосфере Земли. Озоновый слой защищает поверхность Земли от вредного ультрафиолетового излучения, поглощая его и предотвращая его проникновение на поверхность. Однако, использование некоторых химических веществ, таких как фреоны, может привести к разрушению озонового слоя и увеличению проходящего через него ультрафиолетового излучения.
Следовательно, хотя кислород является существенным элементом для жизни на Земле, его воздействие на окружающую среду не является однозначным. Понимание неметаллических свойств кислорода и его экологических последствий позволяет лучше понять его влияние на биосферу и принять эффективные меры для сохранения природной среды.
Слабое проявление свойств кислорода по сравнению с металлами
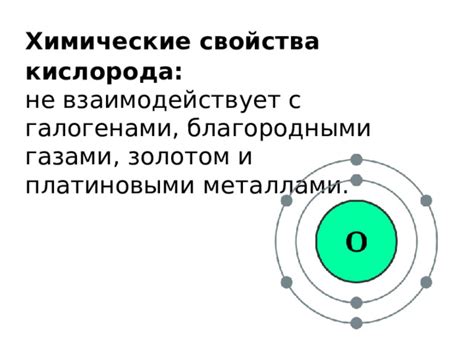
В химической таблице элементов кислород (O) классифицируется как неметалл. Неметаллы обычно обладают слабее выраженными металлическими свойствами по сравнению с металлами. Именно поэтому свойства кислорода, как неметалла, выражены слабее, чем у металлов.
Одним из основных свойств кислорода является его высокая реактивность. Он легко соединяется с другими элементами, образуя соединения, такие как оксиды. Кислород также является хорошим окислителем, способным вступать в окислительные реакции с различными веществами.
Однако, по сравнению с металлами, кислород не обладает великим количеством металлических свойств. Например, он не имеет характерной для металлов проводимости электричества и тепла. Кислород не обладает блеском, характерным для металлов, и не может быть подвержен формированию зеркального отражения.
Слабое проявление свойств кислорода по сравнению с металлами объясняется его электронной структурой. Кислород имеет относительно высокую электроотрицательность, что означает его склонность привлекать электроны к себе. Это делает его меньше подверженным потере электронов и формированию ионов, что является важной особенностью металлов.
Вместо этого, кислород образует ковалентные связи с другими элементами, где он делится электронами для образования молекул. Это важно для таких молекул, как вода (H2O) и диоксид углерода (CO2), которые имеют жизненно важное значение для живых организмов и экосистем.
Таким образом, слабое проявление свойств кислорода по сравнению с металлами является результатом его неметаллической природы и электронной структуры. Несмотря на свое слабое проявление, кислород остается одним из ключевых элементов, необходимых для поддержания жизни на Земле.



