Белки – это основные строительные компоненты живых организмов. Они играют важную роль в биохимических процессах и выполняют разнообразные функции. Каждый белок состоит из длинной цепочки молекул, называемых аминокислотами. Именно аминокислоты являются мономерами (строительными блоками) белков. Всего существует около 20 различных аминокислот, которые могут быть использованы для создания разнообразных белков.
Строение белков включает в себя последовательные участки аминокислот, которые связаны между собой через пептидные связи. Каждая аминокислота состоит из аминогруппы, карбоксильной группы и боковой цепи. Различная последовательность аминокислотных остатков определяет конкретную структуру и функцию белка.
Структура белков может быть разделена на несколько уровней: первичную, вторичную, третичную и кватернарную структуру. Первичная структура белка представляет собой простую последовательность аминокислот. Вторичная структура формируется благодаря взаимодействию между аминокислотами внутри цепочки, образуя спиральные или складчатые участки. Третичная структура определяется пространственным расположением аминокислотных остатков. Кватернарная структура возникает при соединении нескольких полипептидных цепочек в один функциональный комплекс.
Мономеры белков
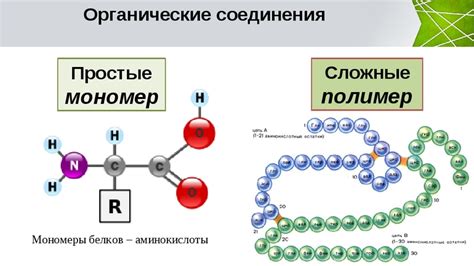
Мономеры белков называются аминокислотами. Они состоят из аминогруппы, карбонильной группы и боковой цепи. Существует 20 различных аминокислот, каждая из которых имеет свою уникальную боковую цепь, определяющую ее свойства и функции. Аминокислоты объединяются в цепочку и образуют белковую молекулу.
Структура белков может быть представлена на трех уровнях: первичная, вторичная и третичная структуры. Первичная структура представляет собой последовательность аминокислот в цепочке. Вторичная структура определяется пространственным порядком аминокислот внутри цепочки и формирует спиральную или прямолинейную структуру. Третичная структура является конечной пространственной конформацией белка и формируется взаимодействием боковых цепей аминокислот.
Мономеры белков являются основой для построения и функционирования всех видов белков в организмах живых существ. Их разнообразие и взаимодействие обеспечивает необходимую гибкость и специфичность биологических процессов.
| Аминокислота | Сокращение | Боковая цепь |
|---|---|---|
| Глицин | Gly | Водород |
| Аланин | Ala | Метильная группа |
| Валин | Val | Изопропильная группа |
| Лейцин | Leu | Изобутильная группа |
| Изолейцин | Ile | Изопропильная группа с метильным атомом |
| Метионин | Met | Сульфогруппа |
Структура белков
Мономерами белков являются аминокислоты. Всего известно около 20 различных аминокислот, которые могут использоваться для синтеза белков. Они отличаются друг от друга химическим составом и боковыми цепями, что позволяет им выполнять различные функции.
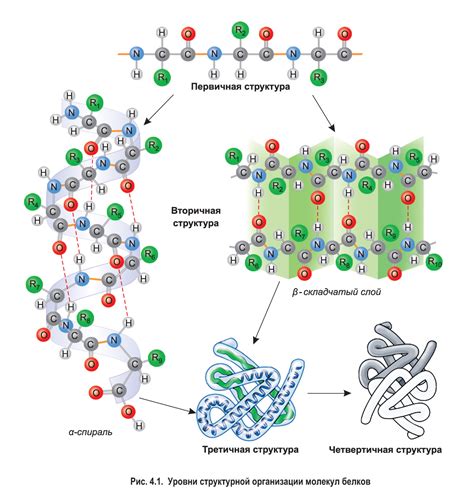
Структура белков включает четыре уровня организации: первичную, вторичную, третичную и кватернарную структуру.
- Первичная структура белка представляет собой последовательность аминокислот, связанных в цепочку. Эта последовательность определяется генетической информацией и является уникальной для каждого белка.
- Вторичная структура белка определяется пространственными взаимодействиями между аминокислотами в цепочке. Она может быть представлена в виде α-спираль или β-складки.
- Третичная структура белка определяется сложной пространственной конфигурацией полипептидной цепи. Она обусловлена взаимодействием между различными участками цепи и может быть свернутой в определенную форму.
- Кватернарная структура белка связана с взаимодействием нескольких полипептидных цепей, образующих многоцепочечный комплекс. Она определяет конечную форму и функцию белка.
В целом, структура белков играет критическую роль в их функционировании. Отклонения или мутации в структуре белка могут привести к нарушению его функций и возникновению различных заболеваний.
Праймерная структура

Структура белка можно разделить на несколько уровней: праймерная (первичная) структура, вторичная структура, третичная структура и кватернивая структура.
Праймерная структура белка определяется последовательностью аминокислот в полипептидной цепи. Каждая аминокислота в полипептиде имеет свою специфическую химическую группу боковой цепи, которая влияет на образование связей с другими аминокислотами. Полипептидная цепь содержит начальную аминокислоту (N-концевую) и конечную аминокислоту (C-концевую).
Праймерная структура белков играет важную роль в определении их функций. Даже небольшое изменение в последовательности аминокислот может привести к изменению химических свойств белка, что может повлиять на его способность участвовать в биологических процессах.
Вторичная структура
Основными типами вторичной структуры являются α-спираль и β-листы. Альфа-спираль образуется благодаря переходу полипептидной цепи в стабильную спиральную форму, где каждый аминокислотный остаток связан с ближайшими соседями в цепи. Бета-листы представляют собой параллельные или антипараллельные укладки полипептидной цепи в виде слоев или свернутых лент.
Вторичная структура белка играет важную роль в его функции. Она помогает обеспечить стабильность молекулы белка и его взаимодействие с другими молекулами. Также вторичная структура может быть определена с помощью различных методов, включая рентгеноструктурный анализ и ядерное магнитное резонансное исследование.
Вместе с первичной структурой, вторичная структура белка является основным элементом его третичной и четвертичной структуры. Она определяет пространственное расположение различных участков белка и позволяет ему выполнять специфические функции в организме.
Третичная структура

Третичная структура белков представляет собой сложную пространственную организацию аминокислотных остатков, которая определяется последовательностью их расположения в полипептидной цепи. Эта структура формируется в результате взаимодействия боковых цепей аминокислот, обусловленных различными типами химических связей.
В третичной структуре белка выделяются различные уровни организации:
- Уровень первичной структуры определяется последовательностью аминокислотных остатков в полипептидной цепи. Эта последовательность закодирована в генетической информации.
- Уровень вторичной структуры представляет собой пространственное упорядочение сегментов полипептидной цепи. Наиболее распространенными типами вторичной структуры являются α-спираль и β-складка.
- Уровень третичной структуры определяет пространственное расположение всей полипептидной цепи. Он формируется под влиянием водородных связей, ионных связей, гидрофобных взаимодействий и дисульфидных мостиков между боковыми цепями аминокислот.
- Уровень кватернерной структуры является специфичной организацией нескольких полипептидных цепей в большие мультипротомеры. В этом случае полипептидные цепи могут быть одинаковыми или различными по последовательности аминокислотных остатков.
Третичная структура белка обеспечивает его функциональность, поскольку она определяет пространственно-конфигурационные особенности активных центров, мест связывания с другими молекулами и способность к взаимодействию с рецепторами.
Кватернарная структура

Кватернарная структура белков представляет собой трехмерное особое сочетание подуниверсалов. Она возникает за счет взаимодействия и связывания нескольких полипептидных цепей, называемых субъединицами. Образование кватернарной структуры происходит благодаря взаимным взаимодействиям между различными субъединицами.
Основная цель образования кватернарной структуры заключается в усилении функциональности и стабильности белка. Она позволяет белку приобретать дополнительные свойства и функции, такие как каталитическая активность, регуляция и специфическое связывание с другими молекулами.
Субъединицы могут быть однотипными или разнотипными, что определяет особенности кватернарной структуры. Для некоторых белков кватернарная структура является незаменимым условием для полноценного функционирования, так как она обеспечивает более сложную трехмерную архитектуру и стабильность структуры.
Однако, не все белки образуют кватернарную структуру. Некоторые белки существуют только в мономерной форме, представляя собой одну полипептидную цепь. Такие белки обычно выполняют одну конкретную функцию и не требуют сложного взаимодействия с другими подуниверсалами для своего функционирования.
| Белок | Субъединицы | Функции |
|---|---|---|
| Гемоглобин | 4 субъединицы (2 α-цепи и 2 β-цепи) | Транспорт кислорода и углекислого газа |
| Инсулин | 2 субъединицы (А и В цепи) | Регуляция уровня глюкозы в крови |
Функции белков
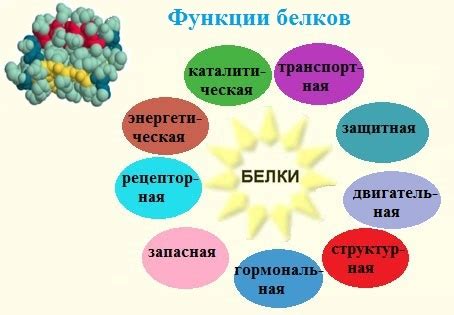
1. Структурная функция: Белки служат строительным материалом для клеток и тканей. Они формируют каркас клетки и обеспечивают прочность и устойчивость структур организма. Например, коллаген – основной структурный белок в соединительной ткани, придает коже эластичность и упругость.
2. Катализаторы: Белки, известные как ферменты, ускоряют химические реакции в организме. Они помогают разлагать пищу, обеспечивают превращение пищевых веществ в более простые формы и контролируют обмен веществ.
3. Транспортные функции: Некоторые белки играют роль переносчиков веществ в организме. Например, гемоглобин в эритроцитах переносит кислород к клеткам организма, а белки-переносчики в плазме крови обеспечивают транспорт различных молекул, таких как гормоны и липиды.
4. Регуляторные функции: Белки участвуют в регуляции многих процессов в организме. Например, гормоны – это белки, которые регулируют различные функции органов и систем организма. Также белки играют ключевую роль в регуляции генной активности, контролируя экспрессию генов.
5. Защитная функция: Иммунные белки, такие как антитела, играют важную роль в защите организма от инфекций. Они опознают и связываются с инфекционными агентами, помогая в их уничтожении или нейтрализации.
6. Энергетическая функция: В некоторых случаях белки могут быть использованы как энергетический источник. В период голодания или недостатка углеводов организм может разлагать белки в аминокислоты и использовать их как источник энергии.
Таким образом, белки являются универсальными молекулами, которые выполняют разнообразные функции в организме. Их строение и свойства позволяют им выполнять специфические задачи и играть важную роль в поддержании жизни.



