Молярность – это физическая величина, определяющая количество моль вещества, растворенного в единице объема раствора. Найдем молярность 6Н раствора AlCl3.
Сначала разберемся, что означает обозначение 6Н. Заглавная буква "Н" обозначает нормальность раствора. Нормальность – это количество эквивалентов растворенного вещества, приходящееся на 1 литр раствора. Таким образом, 6Н означает, что на 1 литр раствора AlCl3 приходится 6 эквивалентов вещества (Алuminium Chloride).
Молярность можно получить, зная нормальность раствора и молярную массу растворенного вещества. Молярная масса AlCl3 равна 133.34 г/моль. Используя формулу медленного считывания c = N × M, где c – молярность, N – нормальность, M – молярная масса, можем вычислить молярность 6Н раствора AlCl3.
Молярность 6H раствора AlCl3

6H раствор означает, что в каждом литре раствора содержатся 6 молей вещества. В данном случае, исходным веществом является AlCl3, то есть хлорид алюминия.
Хлорид алюминия – это бинарное неорганическое соединение, которое представляет собой соль алюминия и хлора. Хлорид алюминия широко применяется в различных областях, включая производство лекарств, фармацевтику и металлургию.
Чтобы рассчитать молярность 6H раствора AlCl3, необходимо знать его формулу и молекулярную массу. Молярная масса AlCl3 равна сумме масс алюминия и трех хлоровых атомов:
Молярная масса AlCl3 = масса алюминия + 3 * масса хлора
Зная молярную массу AlCl3, можно рассчитать количество граммов AlCl3 в 6H растворе. Для этого необходимо знать объем раствора.
Итак, молярность раствора AlCl3 можно рассчитать по формуле:
Молярность = количество молей AlCl3 / объем раствора (в литрах)
Молярность 6H раствора AlCl3 будет равна 6 молям AlCl3 на 1 литр раствора.
Рассчитайте молярность 6H раствора AlCl3, чтобы определить концентрацию этого раствора с точки зрения количества растворенного вещества.
Определение молярности

Молярность (М) определяется как количество молей растворенного вещества, деленное на объем раствора в литрах. Единицы измерения молярности - моль на литр (моль/л) или моляр (M).
Для определения молярности раствора необходимо знать количество растворенного вещества и объем раствора. Эти данные позволяют рассчитать количество молей вещества в растворе и выразить его в молях на литр (моль/л).
Например, чтобы определить молярность 6Н раствора AlCl3, необходимо знать, сколько молей AlCl3 содержится в 1 литре данного раствора. Значение "6Н" указывает на то, что в 1 литре раствора содержится 6 молей кислоты или щелочи. Поэтому молярность данного раствора AlCl3 составляет 6 молов на литр (6 М).
Состав раствора AlCl3
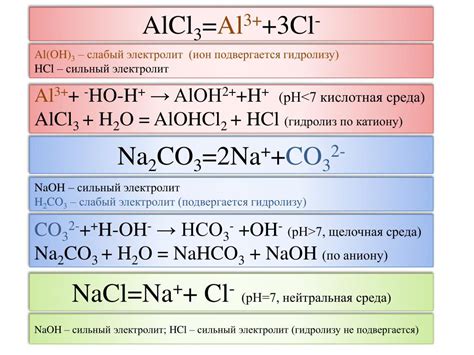
Молярность раствора AlCl3 указывает на количество молей алюминия хлорида, растворенных в одном литре раствора. Таким образом, если раствор имеет молярность 6 Н (неормальной концентрации), это значит, что в одном литре раствора содержится 6 молей AlCl3.
Обратите внимание, что молярность раствора AlCl3 может быть изменена путем добавления или удаления вещества, чтобы достичь требуемой концентрации. А также, при добавлении AlCl3 в воду, раствор будет обладать кислой реакцией, так как AlCl3 является солью слабого основания и сильной кислоты.
Способы вычисления молярности

Существует несколько способов вычисления молярности:
1. Использование массы и молярной массы вещества
Для этого способа нужно знать массу растворенного вещества и его молярную массу. Молярность (М) раствора можно вычислить по формуле:
М = масса вещества (г) / молярная масса вещества (г/моль) / объем раствора (л)
2. Использование моль и объема раствора
Для этого способа нужно знать количество молей растворенного вещества и объем раствора в литрах. Молярность (М) раствора можно вычислить по формуле:
М = количество молей вещества (моль) / объем раствора (л)
3. Использование эквивалентной массы вещества
Этот способ применяется для рассчета молярности реактивов, обладающих различными валентностями. Молярность (М) раствора можно вычислить по формуле:
М = количество эквивалентов реактива (экв) / объем раствора (л)
Выбор способа вычисления молярности зависит от доступной информации о растворенном веществе и необходимости получения конкретной величины.
Влияние температуры на молярность раствора

При повышении температуры молярность раствора может измениться из-за двух основных факторов:
1. Растворимость вещества
Растворимость вещества зависит от температуры. Некоторые вещества имеют большую растворимость при повышенной температуре, в то время как другие имеют меньшую растворимость. При повышении температуры количество растворенного вещества может увеличиваться или уменьшаться, что приводит к изменению молярности раствора.
Например, растворимость некоторых солей увеличивается с повышением температуры. Это означает, что при повышении температуры растворности таких солей в растворе будет больше, что ведет к увеличению молярности раствора.
2. Объем раствора
Температура также может влиять на объем раствора. При повышении температуры объем раствора может увеличиваться. Это происходит из-за термического расширения раствора, что приводит к увеличению молярности раствора.
В обратном случае, при понижении температуры объем раствора может сокращаться и, следовательно, молярность раствора может увеличиваться.
Таким образом, изменение температуры может вызывать изменение молярности раствора из-за изменения растворимости вещества или объема раствора. Влияние температуры на молярность раствора является важным фактором, который необходимо учитывать при проведении экспериментов и расчетах в химических реакциях.
Значение молярности в химических реакциях

В химии молярность обозначается символом М и измеряется в молях на литр (моль/л). Молярность раствора определяется как отношение количества растворенного вещества (в молях) к объему растворителя (в литрах).
Молярность играет ключевую роль при проведении реакций, так как воздействует на скорость и степень протекания химических превращений. Она определяет скорость реакции и изменение концентрации вещества со временем.
Например, молярность 6Н раствора AlCl3 означает, что в одном литре раствора содержится 6 моль хлорида алюминия. Это означает, что такой раствор обладает достаточно высокой концентрацией и может быть использован для проведения реакций, требующих большого количества этого вещества.
Значение молярности раствора является важным показателем, который помогает определить, сколько вещества вступает в реакцию и как оно будет влиять на характер протекания данной химической реакции.
Примеры использования AlCl3 в промышленности

1. Производство алюминия: AlCl3 важен в процессе получения алюминия из минеральной руды. Он используется в химическом процессе, называемом процессом Холла-Геру, который позволяет значительно снизить затраты на производство алюминия.
2. Катализатор в органическом синтезе: AlCl3 является мощным катализатором в органическом синтезе. Он широко применяется в процессах ацилирования и алкилирования, а также в реакциях Фриделя-Крафтса. Это позволяет получать различные органические соединения, такие как ароматические соединения, эфиры и хлорированные производные.
3. Производство полимеров: AlCl3 используется в производстве полимеров, таких как полиэтилен и полипропилен. Он применяется в качестве катализатора в процессе полимеризации, который позволяет получить высокомолекулярные соединения с нужными характеристиками.
4. Очистка воды: AlCl3 может использоваться для обеззараживания и очистки воды. Этот химический реагент удаляет загрязнения, такие как бактерии, вирусы и тяжелые металлы, и позволяет получить чистую питьевую воду. Он также может быть использован в процессах обработки сточных вод.
Все эти примеры демонстрируют разнообразные применения AlCl3 в различных отраслях промышленности, позволяя получить различные химические соединения и обеспечить чистоту и качество воды.
Способы получения 6H раствора AlCl3:
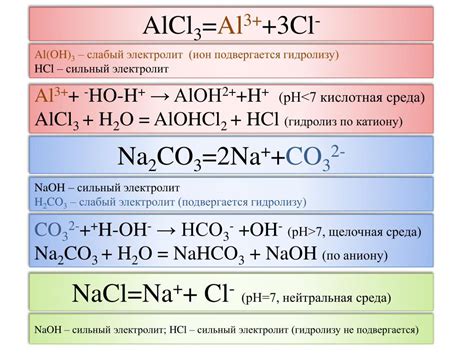
1. Реакция алюминия с хлором:
- Алюминий реагирует с хлором при нагревании в специальной аппаратуре.
- Выделяющийся при этой реакции хлористый алюминий можно растворить в воде, получив 6H раствор AlCl3.
2. Реакция алюминия с соляной кислотой:
- Алюминий реагирует с соляной кислотой, образуя хлористый алюминий и водород.
- Полученный хлористый алюминий можно растворить в воде для получения 6H раствора AlCl3.
3. Реакция хлорида алюминия с водой:
- Хлорид алюминия, полученный другими способами, реагирует с водой, образуя 6H раствор AlCl3 и выделяющийся хлороводород.
- Полученный раствор можно очистить и использовать в различных химических процессах и реакциях.
Особенности химических свойств раствора AlCl3

Раствор AlCl3, образуемый при растворении алюминиевого хлорида в воде, обладает несколькими особенностями в своих химических свойствах.
Во-первых, AlCl3 растворяется в воде с образованием комплексных ионов. В чистом виде алюминиевый хлорид представляет собой красно-фиолетовые кристаллы, но при взаимодействии с водой образуется гидратированный ион [Al(H2O)6]3+, обеспечивая стабилизацию раствора.
Во-вторых, раствор AlCl3 обладает кислотными свойствами. При взаимодействии со щелочами или основаниями происходит образование соответствующих алюминиевых солей и соответствующих фторидов. Например, реакция AlCl3 с NaOH приводит к образованию соли NaAl(OH)4 и выделению хлороводорода (HCl).
В-третьих, AlCl3 образует комплексы с органическими соединениями. Эти комплексы могут быть использованы в синтезе органических соединений и служат важными реагентами в органической химии.
Таким образом, раствор AlCl3 обладает специфическими химическими свойствами, которые определяют его широкое применение в различных областях химической и органической технологии.



