Водород - это легкий химический элемент, обладающий самым минимальным атомным номером в периодической системе Менделеева. Он известен своей простотой и уникальными физическими свойствами. Водородная молекула состоит из двух атомов водорода, соединенных с помощью ковалентной связи.
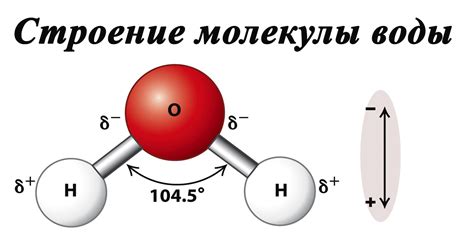
На другом полюсе находится вода - одно из самых распространенных веществ на Земле. Молекула воды состоит из двух атомов водорода, связанных с атомом кислорода. Водородные связи между атомами водорода и атомами кислорода делают молекулу воды уникальной.
Основное различие между молекулами водорода и воды заключается в их составе и структуре. Молекула водорода состоит только из двух атомов водорода, в то время как молекула воды содержит атомы водорода и атомы кислорода.
Еще одно существенное различие между молекулами водорода и воды - их физические свойства. Водород является легким, бесцветным и химически инертным газом при комнатной температуре и давлении. Вода, в свою очередь, является жидкостью при этих условиях и обладает уникальными теплоемкостью, плотностью и растворительными свойствами.
Структура и свойства молекулы водорода
Молекула водорода (H2) состоит из двух атомов водорода, связанных ковалентной связью. Водородные атомы имеют один электрон в своей валентной оболочке, что позволяет им образовывать связь вода-водород.
Молекула водорода является самой простой молекулой и имеет уникальные свойства. Она является недвижущейся, неметаллической, бесцветной и бесчувственной. При комнатной температуре и давлении, водород находится в газообразной форме.
Молекула водорода имеет малую массу и атомный радиус, что делает ее очень подвижной и способной проникать через многие материалы. Это особое свойство делает водород важным компонентом в реакционных процессах, включая восстановление и окисление других веществ.
Структура молекулы водорода также определяет ее химические свойства. Из-за наличия двух атомов водорода, молекула обладает возможностью образования ковалентных связей с другими атомами. Это делает водород очень реактивным элементом и предоставляет ему возможность участвовать в различных химических реакциях.
В заключении, молекула водорода обладает простой структурой и интересными свойствами. Ее небольшая масса и подвижность делают ее важным компонентом в химических реакциях, а наличие двух атомов водорода открывает много возможностей для образования связей с другими веществами.
Структура и свойства молекулы воды

Одно из уникальных свойств молекулы воды - ее способность образовывать водородные связи. Хотя атомы водорода слабо электроотрицательны, они все же образуют положительные частицы, а кислород - отрицательную. Благодаря этому, молекулы воды могут образовывать сильные водородные связи между собой, влияя на множество ее физических и химических свойств.
| Свойство | Описание |
|---|---|
| Полярность | Молекула воды имеет полярную структуру, что обусловлено взаимодействием кислорода и водорода. Это позволяет воде образовывать водородные связи и быть отличным растворителем для поларных молекул и ионов. |
| Теплоемкость | Вода обладает высокой теплоемкостью благодаря водородным связям. Это делает ее стабильным теплоносителем и защищает организмы от резких перепадов температур. |
| Теплота парообразования | Вода обладает высокой теплотой парообразования, в результате чего ее испарение охлаждает окружающую среду. Это явление играет важную роль в регуляции климата на Земле. |
| Поверхностное натяжение | Молекулы воды образуют водородные связи не только между собой, но и на границе с другими веществами. Это приводит к поверхностному натяжению, благодаря которому вода может образовывать капли на поверхности и поддерживать свою структуру. |
Структура и свойства молекулы воды делают ее уникальным веществом, которое играет важную роль в жизни на Земле и поддерживает разнообразие живых организмов.
Физические и химические свойства водорода
Физические свойства водорода:
| Свойство | Описание |
|---|---|
| Плотность | 0,0899 г/л при нормальных условиях температуры и давления (0 °C, 1 атм) |
| Температура кипения | -252,9 °C |
| Температура плавления | -259,2 °C |
| Точка росы | -259,2 °C |
| Теплопроводность | 0,1815 Вт/(м·К) |
| Электропроводность | 4,2×10^7 См/м |
| Растворимость | Практически нерастворим в воде, слабо растворяется в органических растворителях |
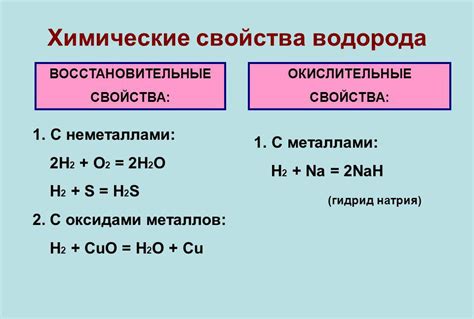
Химические свойства водорода:
Водород является химически активным элементом и может реагировать с другими элементами, веществами и соединениями.
Основные химические свойства водорода:
- Горение
- Окисление
- Участие в реакциях образования соединений
- Образование кислоты при контакте с кислородом
- Образование щелочи при контакте с щелочными металлами
Физические и химические свойства воды

Физические свойства воды:
1. Вода является жидкостью при комнатной температуре и при нормальном атмосферном давлении. Ее плотность составляет около 1 г/см³.
2. Воду можно найти в трех состояниях – жидком, твердом (лёд) и газообразном (пар). Переход из одного состояния в другое происходит при определенных условиях.
3. Вода обладает поверхностным натяжением, благодаря которому она может образовывать капли и пузыри.
4. Вода является отличным растворителем и способна растворять многие вещества, что позволяет ей играть важную роль в живых организмах.
Химические свойства воды:
1. Вода является нейтральной веществом и не имеет ни кислотных, ни щелочных свойств.
2. Вода обладает инертностью и не реагирует с большинством обычных веществ.
3. Вода может быть вовлечена в химические реакции, в результате которых образуются различные соединения.
4. Вода способствует возникновению и поддержанию химических реакций, являясь средой, в которой они происходят.
Изучение физических и химических свойств воды играет важную роль в различных научных и практических областях, таких как химия, биология, пищевая промышленность, экология и другие.



