Координационное число – это число лигандов, или атомов, к которым присоединен центральный атом или ион в комплексном соединении. Оно определяет, сколько лигандов может связаться с центральным атомом или ионом.
В случае соединения хрома CrO3 (трехокисью хрома), координационное число хрома равно 6. Это объясняется тем, что хром в CrO3 имеет октаэдрическую структуру, где центральный атом хрома окружен шестью лигандами оксидными группами (O).
Координационное число хрома в CrO3 имеет большое значение при определении его структуры и свойств. Оно указывает на способность хрома связываться с другими атомами или ионами, что влияет на его реакционную способность и химические свойства.
Значение координационного числа хрома в CrO3:
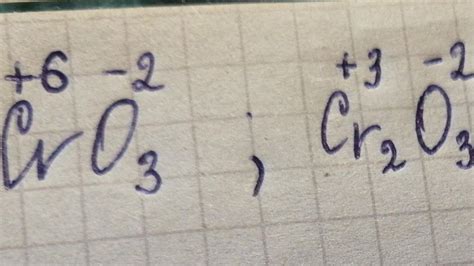
Координационное число (обозначается как ЧН) представляет собой количество лигандов, которые могут образовать координационные связи с одним атомом центрального металла. В случае соединения CrO3 (хромат(VI) кислота), координационное число хрома равно 6.
Это означает, что каждая молекула CrO3 содержит один центральный атом хрома, связанный с шестью лигандами окси-ионами (O2-). Такая геометрия называется октаэдрической, поскольку лиганды располагаются вокруг хрома на вершинах октаэдра.
Координационное число хрома в CrO3 определяет его химические и физические свойства, такие как структура, реакционная активность и способность образовывать комплексы.
Важно отметить, что кислота хромат(VI) является сильным окислителем и имеет ярко-оранжевый цвет. Она обладает разнообразными применениями в области химической промышленности, аналитической химии и других отраслях.
Определение и значение

Координационное число хрома (Cr) в соединении CrO3 определяет количество атомов кислорода, связанных с одним атомом хрома. В данном случае хром имеет координационное число 6, так как каждый атом хрома связан с шестью атомами кислорода.
Координационное число является важным параметром, который указывает на число связей, устанавливаемых атомом центрального иона с окружающими его атомами. Координационное число хрома в CrO3 свидетельствует о том, что каждый атом хрома активно взаимодействует с шестью атомами кислорода, что определяет структуру и свойства соединения.
| Соединение | Координационное число хрома |
|---|---|
| CrO3 | 6 |
| CrCl3 | 6 |
| Cr(CO)6 | 6 |
Знание координационного числа хрома в CrO3 позволяет лучше понять его химические свойства и реакционную способность. Также это число имеет большое значение в рамках координационной химии и определения структуры различных комплексных соединений.
Зависимость от окружающей среды

Координационное число хрома в CrO3 может зависеть от окружающей среды, в которой находится вещество.
Электронное строение хрома в CrO3 представляет собой спинельную структуру, в которой катионы хрома окружены шестью анионами кислорода. Такое окружение обусловлено тем, что хром обладает валентностью +6. В спинельной структуре кислородные анионы формируют кубическую плотную упаковку, в центре которой находятся ионы Cr3+.
Зависимость координационного числа хрома в CrO3 от окружающей среды проявляется в том, что при взаимодействии вещества с другими химическими соединениями или растворителями могут изменяться взаимодействия между ионами и образующимися связями. Это может привести к изменению координационного числа хрома, а следовательно, и к изменению его химических свойств и активности.
Например, в некоторых условиях координационное число хрома в CrO3 может увеличиваться или уменьшаться, что может влиять на его способность образовывать связи с другими молекулами или атомами. Также изменение окружающей среды может влиять на окислительно-восстановительные свойства хрома и его активность в каталитических реакциях.
Таким образом, зависимость от окружающей среды позволяет изменять химические свойства и активность хрома в CrO3, что делает его интересным объектом для исследований и применения в различных областях науки и техники.
Влияние на химическую реакцию между CrO3 и другими веществами
Взаимодействия хром(VI) оксида (CrO3) с различными веществами могут привести к различным химическим реакциям и образованию различных соединений. Ниже приведена таблица с некоторыми примерами реакций и продуктами:
| Вещество | Химическая реакция | Продукт |
|---|---|---|
| Аммиак (NH3) | CrO3 + 4NH3 → [Cr(NH3)4(O)]2+ + H2O | [Cr(NH3)4(O)]2+ |
| Этилен (C2H4) | CrO3 + C2H4 → CrO3(C2H4) | CrO3(C2H4) |
| Этиленгликоль (HOCH2CH2OH) | CrO3 + HOCH2CH2OH → CrO3(HOCH2CH2OH) | CrO3(HOCH2CH2OH) |
Таким образом, реакция между CrO3 и другими веществами может быть различной и приводит к образованию различных продуктов на основе координационного числа хрома.
Применение и использование в практике

Одним из основных применений хромата калия является его использование в производстве красящих веществ и красок. Благодаря своей яркой красной окраске, хромат калия широко применяется в производстве красок для окрашивания различных материалов, включая металлы, стекло, керамику и ткани.
Хромат калия также используется в производстве пигментов для красок и чернил. Эти пигменты обладают стойкостью к различным физическим и химическим воздействиям, что делает их идеальными для использования в различных промышленных и художественных приложениях.
В медицине хромат калия применяется в виде адъюванта при производстве вакцин. Он помогает усилить иммунный ответ организма на введение вакцины, что повышает эффективность прививок и защищает организм от различных инфекций.
Кроме того, хромат калия используется в производстве противогололедных смесей для обработки дорог. Он помогает снизить температуру замерзания воды и предотвратить образование льда и гололеда на дорожном покрытии, обеспечивая безопасность дорожного движения в зимнее время.



