Энергетические уровни в атоме - это дискретные значения энергии, которые могут принимать электроны, находящиеся вокруг ядра атома. Каждому энергетическому уровню соответствует определенное значение энергии. Число энергетических уровней в атоме зависит от его электронной конфигурации и определяет свойства атома.
Каждый энергетический уровень в атоме имеет определенный набор квантовых чисел, таких как главное квантовое число, орбитальное квантовое число и магнитное квантовое число. Главное квантовое число определяет основной энергетический уровень, орбитальное квантовое число указывает на тип орбитали, на которой находится электрон, а магнитное квантовое число определяет ориентацию орбитали по отношению к внешнему магнитному полю.
Число энергетических уровней в атоме не является постоянным и может изменяться в зависимости от различных факторов, таких как изменение электронной конфигурации при переходах электронов между уровнями или при взаимодействии с другими атомами или молекулами. Также стоит отметить, что значения энергии на каждом уровне не являются абсолютными, а определяются относительно значения энергии на основном уровне.
Атом и его энергетические уровни: всё, что нужно знать
Энергетические уровни в атоме представляют собой определенные дискретные значения энергии электрона. Число энергетических уровней в атоме зависит от его типа и сложности. Например, водородный атом имеет только один энергетический уровень, в то время как более сложные атомы, такие как углеродный или кислородный, имеют несколько энергетических уровней.
Энергетические уровни в атоме имеют определенные значения энергии, которые могут быть выражены в электрон-вольтах или джоулях. Более высокие энергетические уровни находятся на большем расстоянии от ядра и имеют более высокую энергию, а более низкие энергетические уровни находятся ближе к ядру и имеют более низкую энергию.
Переход электрона между энергетическими уровнями может происходить при поглощении или испускании энергии в виде квантов. Квантование энергии объясняется квантовой механикой и является одним из фундаментальных принципов атомной физики.
Изучение энергетических уровней атома является важной задачей в физике и химии. Знание энергетической структуры атомов позволяет понять и объяснить множество явлений, таких как оптические спектры, атомные переходы и химические реакции.
Что такое энергетические уровни в атоме?
Энергетические уровни в атоме представляют собой дискретные значения энергии, которые могут занимать электроны. Они определяют различные энергетические состояния электрона в атоме и играют ключевую роль в понимании структуры атома и его химических свойств.
Каждый энергетический уровень имеет свое определенное значение энергии, которое является результатом квантового механического описания поведения электронов в атоме. Электроны могут находиться либо на основном энергетическом уровне, либо на возбужденных уровнях, в зависимости от своей энергии.
Основной энергетический уровень является самым низким уровнем энергии, на котором электрон может находиться в атоме. Когда электрону сообщают энергию, например, путем поглощения фотона света, он может перейти на один из возбужденных энергетических уровней. Возбужденные уровни имеют более высокую энергию, и электроны обладают большей потенцией для взаимодействия с другими атомами и молекулами.
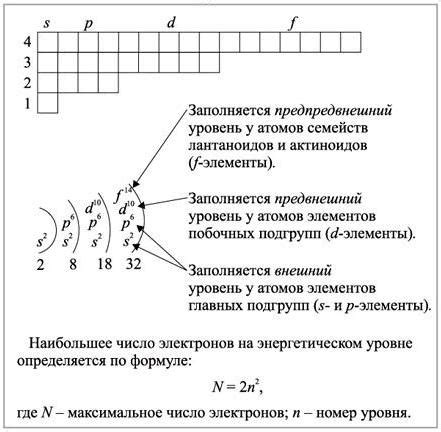
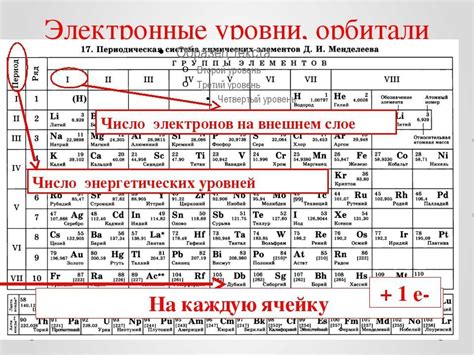
Количество энергетических уровней, доступных электрону в атоме, зависит от его атомного номера и электронной конфигурации. Каждый атом имеет уникальное число энергетических уровней, которые определяют его химические и физические свойства. Понимание энергетических уровней является основой для объяснения химической связи, спектроскопических свойств и многих других явлений, связанных с поведением атомов и молекул.
Каково количество энергетических уровней в атоме?
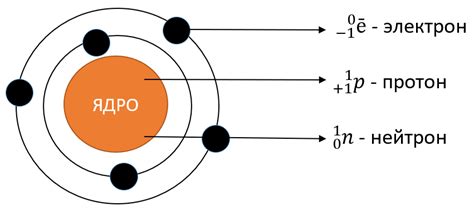
Атом состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, которое образует энергетические уровни. Количество энергетических уровней в атоме зависит от его строения и количества электронов.
На самом верхнем энергетическом уровне находится валентная оболочка, которая определяет химические свойства атома. Валентная оболочка может содержать до 8 электронов, но в некоторых случаях может быть исключение.
Количество энергетических уровней и электронов в атоме может быть представлено с помощью электронной конфигурации. Например, у атома кислорода (O) электронная конфигурация: 1s^2 2s^2 2p^4, где цифры и буквы обозначают соответствующие энергетические уровни и количество электронов на каждом уровне.
Для атомов с одним электроном на внешнем энергетическом уровне, таких как водородный атом (H) или гелиевый атом (He), можно сказать, что у них есть один энергетический уровень. Однако для атомов с несколькими электронами количество энергетических уровней будет больше.
Важно отметить, что валентная оболочка, содержащая последний энергетический уровень, играет ключевую роль в химических реакциях и связывании с другими атомами. Остальные энергетические уровни заполняются электронами в соответствии с правилами Клейна-Гордона и принципом заполнения уровней.
Как связаны энергетические уровни с электронной оболочкой?
Электронная оболочка атома состоит из энергетических уровней, на которых могут находиться электроны. Каждым уровнем оболочки определяется определенная энергия, а также химические и физические свойства атома.
Внутри электронной оболочки находятся подоболочки, которые можно представить как энергетические подуровни. Каждый подуровень может содержать определенное количество электронов, определяемое правилами заполнения подуровней.
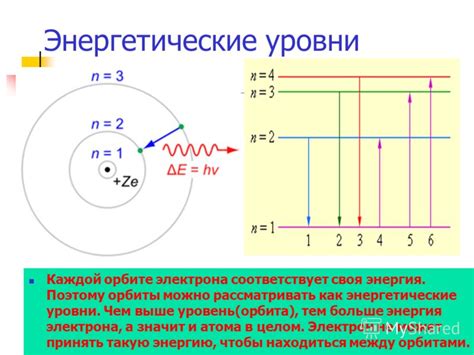
Энергетические уровни находятся на разных расстояниях от ядра атома. Уровни, близкие к ядру, имеют более низкую энергию, а более дальние уровни - более высокую энергию.
Переход электрона с одного энергетического уровня на другой сопровождается испусканием или поглощением энергии в виде электромагнитных волн. Это явление называется атомным спектром и используется для изучения строения атомов и молекул.
Изменение энергетического уровня электрона определяет его состояние и взаимодействие с другими атомами. От энергетических уровней и их заполнения зависят химические свойства атома и его способность образовывать связи с другими атомами.
Таким образом, связь между энергетическими уровнями атома и его электронной оболочкой определяет его химические свойства и реактивность.
Как изменяется расстояние между энергетическими уровнями в атоме?
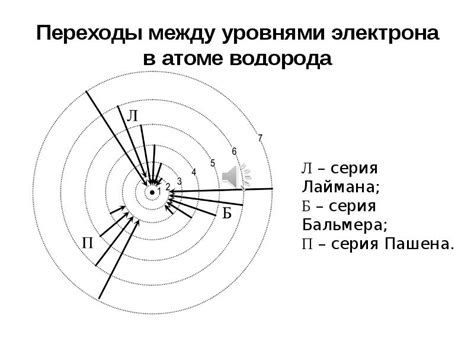
Расстояние между энергетическими уровнями в атоме может изменяться в зависимости от различных факторов. Основные факторы, которые влияют на расстояние между уровнями, включают энергию атома, его размеры и композицию.
Сначала следует отметить, что энергетические уровни атома могут быть дискретными или непрерывными. Дискретные уровни соответствуют квантованным значениям энергии, как это, например, в случае разнообразных оптических и электронных переходов, которые описываются квантовой механикой. Непрерывные уровни соответствуют современному пониманию атомов, в которых энергия напрямую зависит от степеней свободы молекулы и может принимать любые значения.
Расстояние между энергетическими уровнями в дискретной системе может зависеть от заряда ядра атома и количества электронов, находящихся на каждом уровне. Чем выше заряд ядра, тем сильнее притягивается электрон, и, следовательно, расстояние между уровнями становится меньше. Аналогично, чем больше электронов на уровне, тем больше электронов между уровнями, и следовательно, расстояние между уровнями становится больше.
В непрерывной системе, факторы, влияющие на расстояние между уровнями, включают конфигурацию электронных орбиталей атома и наличие атомных или молекулярных фазовых переходов. Например, переход от низкоэнергетического основного состояния атома к возбужденному состоянию может привести к изменению расстояния между энергетическими уровнями.
Таким образом, расстояние между энергетическими уровнями в атоме может быть изменено различными факторами, такими как заряд ядра, количество электронов на уровне, конфигурация орбиталей и наличие фазовых переходов. Понимание этих факторов помогает в объяснении и прогнозировании различных свойств и процессов, связанных с энергетическими уровнями в атоме.
Какие свойства имеют энергетические уровни в атоме?
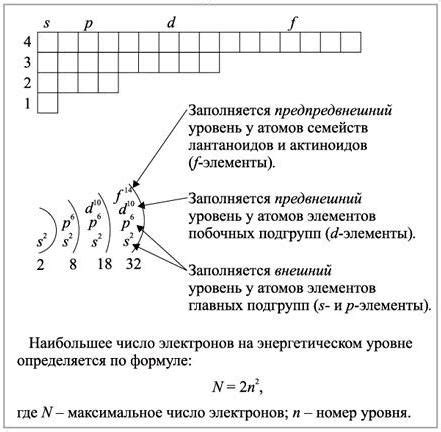
Энергетические уровни в атоме обладают рядом важных свойств, которые определяют их роль в структуре и поведении атома:
- Квантовая природа: энергетические уровни в атоме являются квантовыми, то есть они имеют дискретные значения и не могут принимать произвольные значения энергии.
- Орбитальная структура: энергетические уровни связаны с орбиталями, на которых находятся электроны атома. Каждый уровень соответствует определенной энергии электрона и определяет его положение в атоме.
- Ледовые правила: энергетические уровни в атоме подчиняются ледовым правилам заполнения электронами. Согласно этим правилам, электроны заполняют уровни с наименьшей энергией сначала.
- Энергетическая диаграмма: энергетические уровни могут быть представлены в виде энергетической диаграммы, на которой отображаются различные уровни энергии и их относительные положения.
- Переходы между уровнями: энергетические уровни в атоме могут меняться при взаимодействии с электромагнитным излучением или другими частицами. Такие переходы между уровнями может сопровождать испускание или поглощение энергии в виде фотонов.
Знание свойств энергетических уровней позволяет понять и объяснить различные физические явления, связанные с атомами, включая электронную структуру, оптические свойства и химические реакции.
Как взаимодействуют энергетические уровни в атоме с внешними воздействиями?
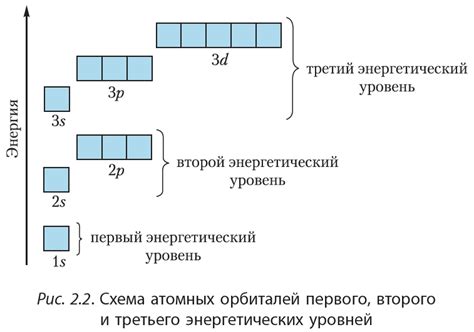
Энергетические уровни в атоме играют ключевую роль во взаимодействии с внешними воздействиями. Они определяют возможные состояния энергии, которые атом может принимать под воздействием различных факторов.
Внешние воздействия, такие как электромагнитное излучение, электрическое или магнитное поле, атомные столкновения и другие, могут вызывать переходы между энергетическими уровнями. При этом атом поглощает или испускает фотоны с определенными энергиями, соответствующими разности энергетических уровней.
Переходы энергетических уровней в атоме часто сопровождаются излучением или поглощением света определенной частоты, что объясняет, например, явления излучения электронов в атомах при возбуждении или релаксации. Каждый энергетический уровень имеет свою специфическую энергию и время жизни, которые определяются свойствами атома и его окружения.
Внешние воздействия могут не только приводить к переходам между энергетическими уровнями, но и изменять их распределение и строение. Например, наличие внешнего поля может вызвать расщепление энергетических уровней, создавая новые возможности для переходов между ними.
Исследование взаимодействия энергетических уровней с внешними воздействиями в атомах имеет большое значение во многих научных областях, включая физику, химию, электронику и фотонику. Понимание этих процессов позволяет разрабатывать новые технологии, например, для создания лазеров, светодиодов и квантовых компьютеров.



