Периодическая система химических элементов Менделеева – это удивительный инструмент, который позволяет упорядочить и классифицировать все известные химические элементы. Один из основных принципов этой системы – разделение элементов на группы. Каждая группа имеет свою нумерацию и определенные химические свойства.
Группа – это столбец элементов в таблице Менделеева. Одна из главных характеристик всех элементов в определенной группе – количество электронов на внешнем энергетическом уровне. Это количество электронов влияет на то, как элементы взаимодействуют с другими элементами и какие связи они могут образовывать.
Каждая группа в таблице Менделеева имеет свою химическую характеристику, связанную с их внешней электронной конфигурацией. Некоторые группы являются металлами, другие – полуметаллами или неметаллами. Некоторые элементы могут быть реактивными и образовывать сильные химические соединения, в то время как другие элементы могут быть инертными и практически не взаимодействовать с другими веществами.
Роль группы в таблице Менделеева в химии
Таблица Менделеева, являющаяся основой химического знания, состоит из строк и столбцов, которые группируют элементы по их химическим свойствам и электронному строению. Группы в таблице Менделеева играют важную роль в определении химических свойств и реакций элементов.
Каждая группа в таблице Менделеева содержит элементы с одинаковым количеством валентных электронов на последнем энергетическом уровне. Валентные электроны определяют основные химические свойства элемента, такие как способность образовывать соединения и участвовать в химических реакциях.
Элементы в одной группе имеют похожие свойства, потому что они имеют схожее электронное строение и способность образовывать соединения с похожей реакционной активностью. Например, группа щелочных металлов (1 группа) состоит из элементов с одним валентным электроном, который легко отделяется, что делает эти элементы высоко реакционноспособными.
Группы также позволяют устанавливать тренды в свойствах элементов. Например, внутри одной группы, размер атома и ионов увеличивается сверху вниз, что влияет на их химическую активность и реакционнную способность.
Знание о группах в таблице Менделеева позволяет предсказывать химические свойства и реакции элементов, а также строить определенные соединения с необходимыми свойствами. Это обеспечивает фундаментальное понимание химии и служит основой для различных отраслей науки и промышленности.
Группа элементов и их химические свойства
В таблице Менделеева элементы разделены на группы в соответствии с их атомной структурой и химическими свойствами. Каждая группа содержит элементы, которые имеют схожие химические свойства и реактивность.
Группа элементов определяет их основные химические свойства. Некоторые группы в таблице Менделеева имеют общие особенности, такие как плавучесть или реактивность с водой.
Группа элементов может влиять на их способность образовывать соединения или проявлять определенные химические реакции. Например, элементы из группы алкалий имеют склонность к образованию ионов с положительным зарядом, а элементы из группы галогенов имеют склонность к образованию ионов с отрицательным зарядом.
Также, группа элементов может влиять на их физические свойства, такие как плотность, точка плавления и кипения. Некоторые группы элементов могут иметь похожие свойства, но отличаться в одном или нескольких параметрах.
Все элементы в группе имеют одинаковое число электронных оболочек, что обуславливает схожие химические свойства. Однако, каждый элемент в группе имеет свое уникальное количество электронов во внешней оболочке, что определяет его реактивность и способность вступать в химические реакции.
Изучение группы элементов и их химических свойств позволяет понять общие закономерности и принципы химических реакций. Это имеет большое значение для развития новых веществ и материалов, а также для понимания процессов, протекающих в живой природе.
Химические свойства группы элементов в таблице Менделеева
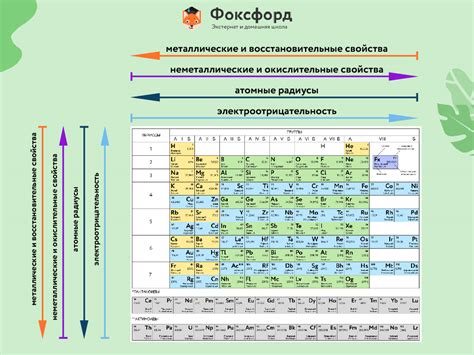
Каждая группа элементов в таблице Менделеева имеет свои характерные химические свойства. Например, в первой группе, также известной как группа щелочных металлов, находятся литий, натрий, калий и другие элементы. Щелочные металлы обладают высокой реактивностью и легко образуют ионные соединения с другими элементами. Они реагируют с водой, выделяя водород и образуя гидроксиды.
Элементы во второй группе таблицы Менделеева, известной как группа щелочноземельных металлов, также обладают своими уникальными химическими свойствами. Щелочноземельные металлы, такие как магний, кальций и стронций, менее реактивны, чем щелочные металлы, но все равно способны образовывать ионные соединения.
В третьей группе таблицы Менделеева расположены элементы, такие как алюминий и галлий, которые обладают своими особыми свойствами. Эти элементы часто используются в производстве легких металлов и различных алюминиевых соединений.
Каждая группа в таблице Менделеева имеет свои химические тренды и закономерности. Например, элементы одной группы ведут себя схоже в химических реакциях и образуют аналогичные соединения. Знание химических свойств и закономерностей групп элементов в таблице Менделеева позволяет ученым предсказывать и исследовать новые соединения и реакции.
Общие химические свойства групп элементов в таблице Менделеева позволяют лучше понять и описать разнообразие химических реакций и соединений в природе. Таблица Менделеева является необходимым инструментом для изучения и понимания мира химии и играет важную роль в научных исследованиях и промышленности.



