Внутренняя энергия – это одно из важнейших понятий в физике и химии, которое описывает общую сумму всех форм энергии, находящейся внутри системы. Она включает в себя энергию частиц, их движение и взаимодействия, а также энергию связей между атомами и молекулами. Внутренняя энергия может проявляться в виде теплоты, работы и изменения состояния системы.
Основным принципом изменения внутренней энергии является принцип сохранения энергии. Согласно этому принципу, энергия не может быть создана или уничтожена, она может только переходить в другие формы. Внутренняя энергия системы может изменяться благодаря теплообмену с окружающей средой, выполнению работы или химическим реакциям. Например, при нагревании системы ее внутренняя энергия увеличивается, а при охлаждении – уменьшается.
Внутренняя энергия оказывает существенное влияние на состояние системы. Изменение ее значения может приводить к изменению физических и химических свойств вещества, изменению фазы вещества или даже разрушению системы. Поэтому изучение внутренней энергии является важной задачей при решении различных научных и технических проблем.
Концепция внутренней энергии

Основанная на законах сохранения энергии, концепция внутренней энергии утверждает, что энергия может быть перераспределена внутри системы, но ни в коем случае не может быть создана или уничтожена. Таким образом, внутренняя энергия системы остается постоянной во времени, за исключением случаев, когда она обменивается с окружающей средой.
Внутренняя энергия также может быть влиянием различных факторов, таких как температура, давление и состав системы. Изменение этих параметров может привести к изменению внутренней энергии системы. Например, подогревание воды приводит к увеличению ее внутренней энергии, в результате чего вода становится горячей и испаряется.
Внутренняя энергия играет важную роль в термодинамике и механике. Понимание этой концепции позволяет исследовать поведение физических систем, а также определить эффекты изменений входных параметров на работу системы. Кроме того, концепция внутренней энергии активно используется в технике и технологии для оптимизации процессов и разработки новых материалов и устройств.
Понятие и основные принципы
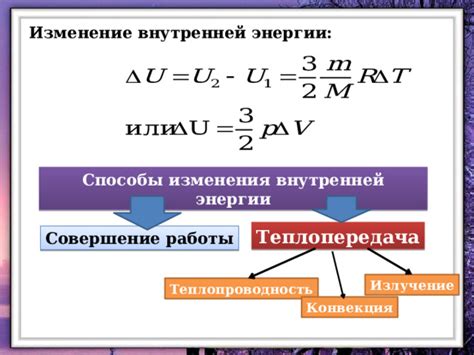
Внутренняя энергия может изменяться как в результате внешней работы, выполняемой над системой, так и в результате изменения теплового взаимодействия с окружающей средой.
Основной принцип изменения внутренней энергии - принцип сохранения энергии. Согласно этому принципу, изменение внутренней энергии равно алгебраической сумме работы, совершенной над системой, и теплового взаимодействия с окружающей средой:
ΔU = Q - W
где ΔU - изменение внутренней энергии системы, Q - тепловое взаимодействие, W - работа, совершенная над системой.
Система, в которой внутренняя энергия не меняется, называется адиабатической. В этом случае принцип сохранения энергии принимает форму:
Q = W
Таким образом, изменение внутренней энергии системы связано с работой, совершенной над системой, и теплообменом с окружающей средой.
Изменение внутренней энергии: теплообмен и работа
Теплообмен - это процесс передачи энергии между системой и окружающей средой в форме тепла. Возможны два вида теплового взаимодействия: нагревание и охлаждение системы. При нагревании системы, энергия в виде тепла переходит из окружающей среды в систему, что приводит к повышению ее внутренней энергии. Наоборот, при охлаждении системы, энергия в виде тепла переходит из системы в окружающую среду, что приводит к уменьшению ее внутренней энергии.
Работа - это форма энергии, связанная с перемещением или изменением состояния системы. Работа может быть совершена над системой или системой самой по себе. Например, совершение работы над газом может привести к его сжатию или расширению, что изменяет его внутреннюю энергию. В то же время, газ в состоянии расширения может сам совершать работу, например, при движении поршня в цилиндре.
Изменение внутренней энергии системы можно выразить следующим образом:
| ΔU = Q - W |
где ΔU обозначает изменение внутренней энергии, Q - количество тепла, переданного системе, а W - работу, совершенную над системой или системой самой по себе.
Таким образом, теплообмен и работа являются основными факторами, влияющими на изменение внутренней энергии системы. Понимание этих процессов и их влияния позволяет более глубоко изучать термодинамику и ее приложения в различных областях науки и техники.
Термодинамическая система и внутренняя энергия

В термодинамике термодинамическая система представляет собой часть физического пространства, которую мы выбираем для анализа и изучения. Термодинамическая система может быть открытой, закрытой или изолированной в зависимости от того, какую тепловую и массовую энергию она обменивает с окружающей средой.
Внутренняя энергия термодинамической системы - это энергия, которая находится внутри системы и зависит от внутренних характеристик системы, таких как температура, давление и состояние вещества. Она может быть представлена в виде суммы кинетической энергии молекул и потенциальной энергии взаимодействия молекул друг с другом.
Изменение внутренней энергии термодинамической системы может происходить за счет изменения ее тепловой энергии или работы, совершаемой над системой. Внутренняя энергия может увеличиваться при подводе тепла к системе или при совершении работы над системой. Одновременное увеличение тепловой энергии и работы может привести к еще большему изменению внутренней энергии.
Основным принципом сохранения внутренней энергии является принцип первого закона термодинамики, который утверждает, что энергия не может быть создана или уничтожена, а только преобразована из одной формы в другую. Это значит, что изменение внутренней энергии термодинамической системы равно сумме теплового эффекта и работы, совершенной над системой.
Изучение внутренней энергии термодинамической системы позволяет понять, как система реагирует на изменения в ее окружении и как энергия переходит между системой и окружающей средой. Знание внутренней энергии системы также играет важную роль в прогнозировании ее поведения и определении оптимальных условий для достижения определенных целей.
| Термодинамическая система | Внутренняя энергия |
|---|---|
| Часть физического пространства, выбранная для анализа и изучения | Энергия, находящаяся внутри системы и зависящая от ее характеристик |
| Может быть открытой, закрытой или изолированной | Может изменяться за счет тепловой энергии и работы |
| Принцип сохранения энергии | Позволяет понять поведение системы и определить оптимальные условия |
Связь внутренней энергии с состоянием системы

Изменение внутренней энергии системы может происходить в результате различных процессов. Например, система может получать или отдавать тепло, выполнять работу или взаимодействовать с окружающей средой. Все эти процессы влияют на внутреннюю энергию системы и могут приводить к ее изменению.
Состояние системы определяется ее внутренней энергией, а также другими параметрами, такими как давление, температура, объем и количество вещества. Изменение внутренней энергии системы связано с изменением этих параметров.
Если система находится в термодинамическом равновесии, то ее внутренняя энергия достигла минимального значения при заданных условиях. Изменение внутренней энергии в этом случае равно нулю, так как система находится в стационарном состоянии.
Внутренняя энергия системы может быть использована для выполнения работы или отдана в виде тепла. При выполнении работы внутренняя энергия системы уменьшается, а при получении тепла - увеличивается. Таким образом, изменение внутренней энергии системы может быть связано как с механической работой, так и с теплообменом.
Изучение связи внутренней энергии с состоянием системы позволяет понять, как система реагирует на изменения внешних условий и как энергия распределяется внутри нее. Это важно для понимания различных физических явлений и процессов, таких как теплопроводность, термодинамические циклы, фазовые переходы и многие другие.
Влияние внутренней энергии на термодинамические процессы

Первый закон термодинамики гласит, что изменение внутренней энергии системы равно сумме теплоты, переданной системе, и работы, совершенной над системой. Таким образом, внутренняя энергия влияет на изменение термодинамической системы в результате получения или отдачи теплоты и совершения или получения работы.
Второй закон термодинамики устанавливает направление тепловых и рабочих процессов, и связан с концепцией энтропии. Внутренняя энергия также влияет на энтропию системы, которая является мерой беспорядка или неупорядоченности в системе. Изменение внутренней энергии может приводить к изменению энтропии системы, что в свою очередь определяет направление процессов.
- При получении теплоты система может изменять свою внутреннюю энергию и расширяться или сжиматься.
- При совершении работы над системой, ее внутренняя энергия также может изменяться.
- Изменение внутренней энергии может привести к изменению температуры системы и ее состояния (переход от одной фазы к другой).
- При изменении внутренней энергии системы может происходить изменение энтропии и, следовательно, возможен процесс увеличения или уменьшения беспорядка в системе.
Таким образом, внутренняя энергия оказывает значительное влияние на термодинамические процессы, определяя изменение состояния системы, ее температуру и энтропию. Понимание этого влияния позволяет лучше понять и управлять поведением и эффективностью различных процессов в рамках термодинамики.
Влияние физических и химических процессов на внутреннюю энергию

Физические процессы, такие как нагревание или охлаждение, могут привести к изменению внутренней энергии системы. Например, при нагревании системы молекулы начинают двигаться быстрее, что приводит к увеличению их кинетической энергии и, следовательно, внутренней энергии системы. При охлаждении происходит обратный процесс - молекулы замедляются, и их кинетическая энергия уменьшается, что приводит к уменьшению внутренней энергии системы.
Влияние химических процессов на внутреннюю энергию отличается от физических процессов. Во время химических реакций происходят изменения в химическом составе системы, что влияет на внутреннюю энергию. Химические реакции могут освобождать или поглощать энергию. Например, при сгорании топлива освобождается энергия в результате химической реакции. Это приводит к увеличению внутренней энергии системы. В свою очередь, при абсорбции энергии во время химической реакции, внутренняя энергия системы увеличивается.
Внутренняя энергия системы может быть также изменена путем передачи энергии с помощью теплового и работающего воздействия. Тепловое воздействие изменяет внутреннюю энергию системы путем переноса энергии через ее границу в результате разности температур. Работающее воздействие изменяет внутреннюю энергию системы путем передачи энергии через ее границу в результате механического воздействия.
| Физические процессы | Химические процессы |
|---|---|
| - Нагревание | - Химические реакции |
| - Охлаждение | - Изменение химического состава |
| - Перенос энергии через границу системы | - Перенос энергии через границу системы |
Изменение внутренней энергии в химических реакциях
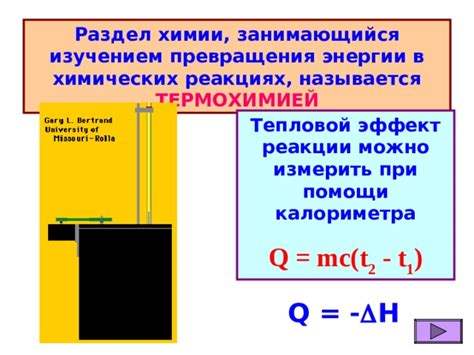
Внутренняя энергия системы может изменяться в химических реакциях в результате изменения связей между атомами и молекулами. Процесс, при котором происходит изменение внутренней энергии в химической системе, называется тепловым эффектом реакции.
В химических реакциях может происходить выделение или поглощение тепла, что приводит к изменению внутренней энергии системы.
Выделение тепла в химической реакции называется экзотермической реакцией. В таких реакциях энергия освобождается в результате образования новых связей между атомами и молекулами. Примером экзотермической реакции является сгорание топлива.
Поглощение тепла в химической реакции называется эндотермической реакцией. В таких реакциях энергия поглощается для образования новых связей между атомами и молекулами. Примером эндотермической реакции является аммония, при которой энергия поглощается для разложения соединения.
Изменение внутренней энергии системы в химической реакции можно определить с помощью измерения теплового эффекта, который является разницей между начальной и конечной энергией системы.
- В экзотермической реакции тепловой эффект отрицателен, так как система отдает энергию окружающей среде.
- В эндотермической реакции тепловой эффект положителен, так как система поглощает энергию из окружающей среды.
Изменение внутренней энергии в химических реакциях играет важную роль при изучении термодинамики и позволяет определить энергетическую эффективность реакции.
Работа и теплообмен при физических процессах
Работа – это форма энергии, передаваемая между системой и окружающей средой. В процессе сжатия газа система может совершать работу над окружающей средой, а в процессе расширения – получать работу от окружающей среды. Работа может быть положительной (когда система совершает работу над окружающей средой) или отрицательной (когда система получает работу от окружающей среды).
Теплообмен – это передача энергии между системой и окружающей средой в форме тепла. Теплообмен может быть положительным (когда система получает тепло от окружающей среды) или отрицательным (когда система отдает тепло окружающей среде). Теплообмен играет важную роль в изменении внутренней энергии системы.
Работа и теплообмен могут изменять внутреннюю энергию системы и, следовательно, ее состояние. При выполнении работы системой ее внутренняя энергия увеличивается, а при получении работы – уменьшается. Теплообмен также влияет на внутреннюю энергию системы: при получении тепла ее внутренняя энергия увеличивается, а при отдаче тепла – уменьшается.
Изменение внутренней энергии системы можно рассчитать как сумму работы и теплообмена: ΔU = Q - W, где ΔU – изменение внутренней энергии системы, Q – теплообмен, W – работа.
Знание работы и теплообмена при физических процессах позволяет изучать изменение внутренней энергии и состояния системы, что является важным в физике и термодинамике.



