Систематическая таблица химических элементов – одно из главных достижений химии, позволяющее упорядочить и систематизировать все химические элементы по их физическим и химическим свойствам. Одним из важных аспектов систематической таблицы является разделение элементов по группам и периодам. Интересно, что порядковый номер группы значительно влияет на физические свойства элементов, определяя их химическую активность, электроотрицательность и многое другое.
Каждая группа систематической таблицы имеет свои особенности и общие химические свойства для всех элементов, расположенных в ней. Например, элементы первой группы имеют общую электронную конфигурацию s1 и являются металлами-щелочными металлами. Они характеризуются очень высокой реактивностью, активностью по отношению к воде и способностью легко образовывать ионы. Элементы второй группы имеют электронную конфигурацию s2 и также являются металлами, но уже менее активными по сравнению с элементами первой группы.
Важно отметить, что с повышением порядкового номера группы влияние порядкового номера становится все менее заметным. В третьей группе элементы уже обладают d-электронами, что придает им отличительные свойства transition-металлов. Самая большая группа систематической таблицы – группа 18, которая находится справа от таблицы. Элементы этой группы называют инертными газами, так как они обычно нереактивны и имеют полностью заполненные электронные оболочки.
Влияние номера группы на свойства элементов
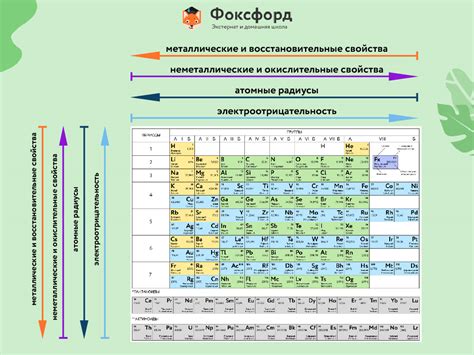
Периодическая таблица элементов химии отражает особые законы и свойства химических элементов. Расположение элементов в таблице происходит по возрастанию порядкового номера и атомного числа. Однако, на физические свойства элементов влияет не только атомное число, но и номер группы, в которой находится элемент.
Номер группы, также известный как номер вертикали в таблице, указывает на количество электронов во внешней электронной оболочке атома. Внешняя электронная оболочка имеет решающее значение для химических свойств элементов. Количество электронов в этой оболочке определяет реакционную способность и химическую активность элемента.
Влияние номера группы на физические свойства элементов проявляется в различной электронной конфигурации и энергетической уровне электронов. Например, элементы в одной группе имеют один и тот же тип внешней электронной оболочки и поэтому обладают схожими химическими свойствами. Они имеют аналогичную реакционную способность и могут образовывать аналогичные соединения.
Кроме того, номер группы также влияет на физические свойства элементов, такие как плотность, температура плавления и кипения, теплоемкость и др. Эти свойства могут различаться в зависимости от электронной конфигурации и энергетического уровня атома.
Изучение и понимание влияния номера группы на свойства элементов позволяет предсказывать и объяснять их химическую и физическую активность. Это важно для разработки новых материалов и прогнозирования их свойств и поведения в химических реакциях и физических процессах.
Физические свойства элементов группы
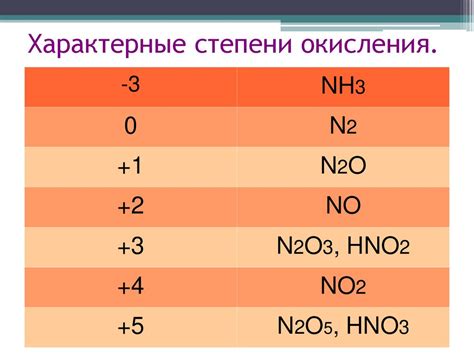
Физические свойства элементов группы определяются как общей структурой и электронной конфигурацией атомов. Например, элементы одной группы имеют схожие химические свойства, так как их электронные оболочки содержат одинаковое число электронов.
Одно из главных физических свойств элементов группы – атомный радиус. Атомный радиус определяет размер атома и характеризует расстояние от центра ядра до внешней электронной оболочки. С увеличением порядкового номера группы, атомный радиус обычно увеличивается, что связано с добавлением новых электронов в электронные оболочки. Так, атомные радиусы элементов группы увеличиваются сверху вниз.
Второе важное физическое свойство элементов группы – электроотрицательность. Электроотрицательность характеризует способность атома притягивать к себе электроны в химической связи. С увеличением порядкового номера группы, электроотрицательность элементов обычно увеличивается. Это связано с более сильным притяжением электронов ядром атома благодаря увеличению заряда ядра и уменьшению атомного радиуса.
Другие физические свойства элементов группы:
- Плотность вещества – с увеличением порядкового номера группы, плотность элементов обычно увеличивается, но в некоторых случаях этот тренд может отсутствовать;
- Температура плавления и кипения – с увеличением порядкового номера группы, температура плавления и кипения элементов обычно увеличивается. Это связано с ростом притяжения между атомами и молекулами, обусловленным увеличивающимся зарядом ядра и уменьшением атомного радиуса;
- Теплопроводность и электропроводность – свойства, зависящие от способности свободные электроны передавать тепло и электрический заряд. С увеличением порядкового номера группы, теплопроводность и электропроводность элементов обычно уменьшаются.
Таким образом, порядковый номер группы оказывает существенное влияние на физические свойства элементов. Понимание этих свойств позволяет лучше понять их химическое поведение и использование в различных областях науки и техники.
Как порядковый номер группы влияет на свойства элементов
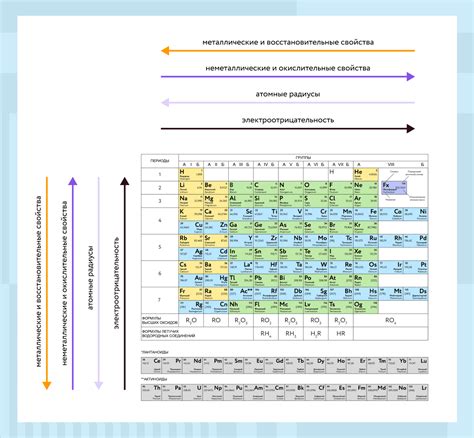
Периодическая закономерность в таблице Менделеева заключается в том, что свойства элементов в одной и той же группе имеют схожие характеристики. Например, элементы в одной группе имеют схожую электронную конфигурацию, что определяет их химическую активность и способность к образованию соединений.
Порядковый номер группы также влияет на физические свойства элементов. Некоторые группы элементов, такие как щелочные металлы (1 группа), щелочноземельные металлы (2 группа) и галогены (17 группа), обладают высокой реактивностью и химической активностью. Это объясняется наличием одного или двух свободных электронов в внешней оболочке атома, которые легко переходят в химические реакции.
Свойства элементов в группе также могут варьироваться в зависимости от блока, в котором они находятся в таблице Менделеева. Например, элементы из блока s имеют свойства, отличающиеся от свойств элементов из блока p.
Основываясь на порядковом номере группы, можно делать предположения о физических свойствах элементов в этой группе. Это может помочь исследователям и химикам в разработке новых материалов и соединений с желаемыми характеристиками.
Имеют ли элементы одной группы схожие физические свойства

Изучение периодической таблицы показывает, что элементы одной группы имеют схожие физические свойства. Например, в группе щелочных металлов (1 группа) элементы имеют низкую плотность, невысокую плавкую и кипящую температуру, высокую реактивность и способность образовывать ионы с положительным зарядом. Это свойственно всем элементам этой группы.
Также можно выделить группу инертных газов (18 группа), которые характеризуются низкой реактивностью, отсутствием окрашенности и негорючестью. Однако, стоит отметить, что не все физические свойства элементов одной группы полностью схожи. Например, в группе неметаллов (14 группа) элементы имеют различные плотности, температуры кипения и плавления, что объясняется их различной строением атомов и способностью образовывать различные химические соединения.
В целом, можно сказать, что элементы одной группы обладают схожими физическими свойствами, однако, влияние других факторов, таких как атомная структура и химические связи, также оказывает влияние на их свойства.



