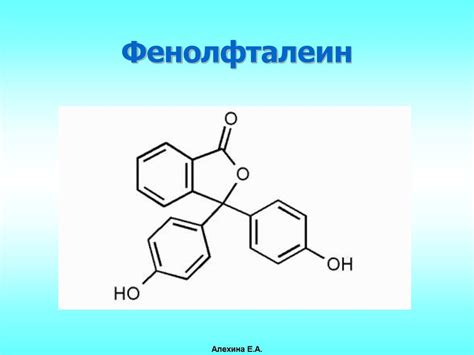
Фенолфталеин - это химическое вещество, известное своей способностью менять цвет в зависимости от своего окружения. Это один из самых популярных индикаторов, используемых в химических и биологических исследованиях.
Фенолфталеин является слабым кислотообразующимсоединением, и его цвет меняется в зависимости от pH раствора, в котором он находится. В кислой среде фенолфталеин остается безцветным, а в щелочной среде становится ярким розовым. Поэтому фенолфталеин часто используется в качестве индикатора в реакциях нейтрализации и определении pH растворов.
Важно отметить, что фенолфталеин имеет свои ограничения и не подходит для всех типов реакций и исследований. Однако, благодаря своей яркой окраске при изменении pH, фенолфталеин остается одним из наиболее широко используемых индикаторов в химической лаборатории.
Фенолфталеин и его применение

Одной из основных областей применения фенолфталеина является химия, особенно в качестве индикатора. Он используется в виде раствора в спирте или воде для определения pH-значений растворов. Фенолфталеин меняет свой цвет в зависимости от кислотности или щелочности раствора. В кислых средах он остается бесцветным или слабо розовым, а в щелочных средах окрашивается в ярно-фиолетовый цвет.
Кроме того, фенолфталеин используется в медицине в качестве слабительного. Его применяют для стимуляции перистальтики кишечника и облегчения запоров. Однако из-за потенциальной токсичности и побочных эффектов, использование фенолфталеина в медицинских препаратах было ограничено или запрещено в некоторых странах.
Фенолфталеин также применяется в эндокринологии для исследования функции щитовидной железы. Он используется в тестах на наличие тиреотропного гормона (TSH) и тироксина (T4) в крови, которые помогают диагностировать различные заболевания щитовидной железы.
Кроме описанных областей применения, фенолфталеин можно также встретить в различных других отраслях, таких как пищевая промышленность, косметология, фармакология и фотография. В пищевой промышленности он может быть использован в качестве красителя или подсластителя.
В целом, фенолфталеин является важным соединением с широким спектром применения в различных областях. Его химические свойства и изменения цвета при изменении pH-значения занимают ведущую роль в его использовании в химии и медицине. Благодаря своей многогранности, фенолфталеин продолжает оставаться важным и интересным объектом исследований и применения.
Реакции фенолфталеина с различными веществами
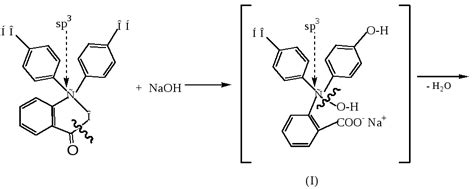
Реакция фенолфталеина со щелочными веществами является одной из основных химических реакций. В щелочной среде фенолфталеин претерпевает диссоциацию и его раствор приобретает розовый цвет. Это явление объясняется образованием ионов фенолфталеината, которые обладают розовой окраской.
С другой стороны, реакция фенолфталеина с кислыми веществами протекает в обратную сторону. При добавлении кислоты в раствор фенолфталеина ионы фенолфталеината превращаются обратно в нейтральное соединение, которое не имеет окраски. В результате раствор теряет свою розовую окраску и становится бесцветным.
Фенолфталеин также реагирует с некоторыми другими веществами, такими как альдегиды и анионы металлов. Реакция с альдегидами приводит к образованию розово-красных соединений, в то время как реакция с анионами металлов может вызывать бесцветные, розовые или фиолетовые окраски, в зависимости от металла и его окислительного состояния.
Таким образом, реакции фенолфталеина с различными веществами могут проявляться в виде цветовых изменений, что делает его незаменимым индикатором в химических исследованиях. Этот соединение является одним из наиболее широко используемых индикаторов и является важным инструментом в химическом анализе и экспериментах.
Цветовые изменения в зависимости от pH среды

При значении pH меньше 8.2 фенолфталеин остается безцветным, а при значении pH больше 8.2 он приобретает ярко-фиолетовую окраску. В щелочной среде фенолфталеин ионизируется, что приводит к образованию фиолетового окрашивающего комплекса.
Изменение цвета фенолфталеина может быть объяснено с помощью принципа лебедевых цветовых пигментов. При нейтральных или кислотных значениях pH, фенолфталеин формирует бесцветный комплекс, где окрашивающие группы не ионизированы и не абсорбируют свет.
Однако, в щелочной среде, окрашивающие группы ионизируются и начинают поглощать свет, что приводит к появлению фиолетового цвета.
Исторически, фенолфталеин был одним из наиболее часто используемых индикаторов pH, особенно в лаборатории химии и на уроках химии в школе. Но сейчас его применение ограничено из-за его потенциальной канцерогенности и репродуктивной токсичности.
Несмотря на это, знание о цветовых изменениях фенолфталеина в зависимости от pH среды остается важным элементом для понимания основ химии и визуального наблюдения протекающих химических реакций.
Применение фенолфталеина в практических целях
1. Индикатор в кислотно-щелочном титровании:
Фенолфталеин используется как индикатор при титровании, чтобы определить точку эквивалентности. В слабо кислой среде он имеет безцветный цвет, а в щелочной среде становится красным. Это позволяет точно определить момент, когда количество добавленного реагента становится достаточным для полного превращения реагирующих компонентов.
2. Показатель рН:
Фенолфталеин используется в лабораторных условиях в качестве показателя рН. В щелочной среде он образует красный цвет, и степень окраски зависит от рН-значения. Это позволяет определить кислотность или щелочность раствора.
3. Определение наличия спирта в жидкостях:
Фенолфталеин используется в криминалистике для определения наличия спирта в жидкостях. Когда фенолфталеин добавляется к жидкости, содержащей спирт, он становится розовым. Более темный оттенок указывает на большее содержание спирта.
4. Фармацевтическое производство:
Фенолфталеин используется в фармацевтической промышленности в процессе производства лекарственных препаратов. Он может использоваться в качестве стабилизатора или индикатора в различных лекарственных формах.
Фенолфталеин является многоцелевым соединением, находящим применение в различных областях. Его свойства и изменения цвета делают его ценным инструментом в химическом анализе и криминалистике, а также в фармацевтической и других промышленностях.



