Радиус атома - одно из основополагающих понятий химической науки. Он является мерой размера атома, определяющей его величину в трехмерном пространстве. Знание о радиусе атомов позволяет лучше понять и предсказывать химические свойства вещества, а также влияние различных факторов на его структуру и связи.
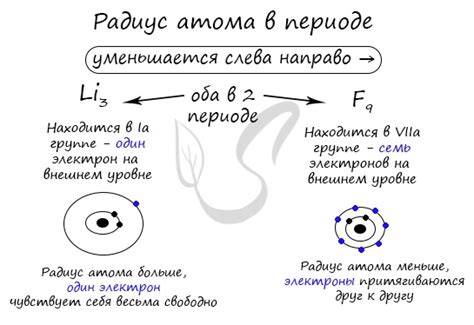
Одним из основных факторов, влияющих на радиус атома, является атомный номер элемента. По мере увеличения атомного номера в периоде, радиус атома обычно уменьшается. Это связано с тем, что с ростом атомного номера возрастает число электронов, а электронная оболочка становится более плотной и силой притяжения ядра к электронам. Таким образом, размер атома уменьшается вдоль периода.
Однако, радиус атома не зависит только от атомного номера, но и от вида атома. Например, радиус катиона (положительно заряженного атома) обычно меньше радиуса атома того же элемента. Это связано с тем, что при потере одного или нескольких электронов электронная оболочка становится меньше, а притяжение ядра к оставшимся электронам усиливается. Также, радиус аниона (отрицательно заряженного атома) обычно больше радиуса атома того же элемента, так как при приобретении электрона электронная оболочка увеличивается, и притяжение ядра к электронам становится менее интенсивным.
Энергетический уровень электрона
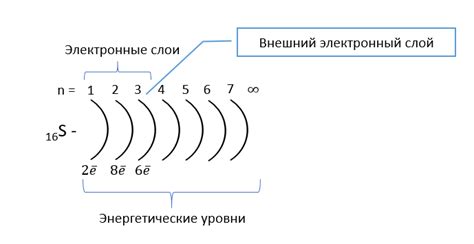
Наиболее близкий к ядру атома электрон находится на первом энергетическом уровне, который имеет наименьшую энергию. Чем дальше от ядра располагается электрон, тем больше его энергия и радиус атома.
Энергетический уровень электрона зависит от его взаимодействия с ядром атома. Чем сильнее притяжение электрона к ядру, тем ниже его энергетический уровень и меньше радиус атома. Влияние электронов на энергетический уровень друг друга также может оказывать влияние на радиус атома.
Количество электронов на энергетическом уровне также может влиять на радиус атома. Если энергетический уровень полностью заполнен электронами, то он становится стабильным, а радиус атома сокращается. Если энергетический уровень частично заполнен, то он становится менее стабильным, а радиус атома увеличивается.
Заряд ядра
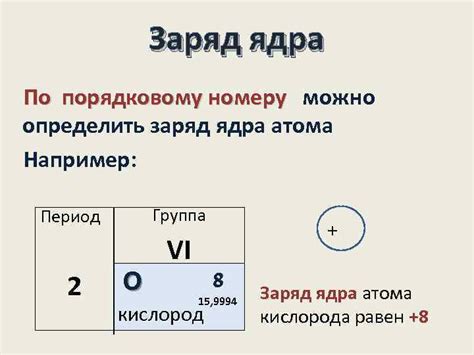
Заряд ядра оказывает сильное электростатическое влияние на электроны, которые обращаются вокруг ядра на различных энергетических уровнях. Протоны ядра притягивают электроны к себе силой электростатического притяжения, которая обратно пропорциональна квадрату расстояния между ними.
Чем больше заряд ядра, тем сильнее оно притягивает электроны. Вследствие этого радиус атома уменьшается, поскольку электроны находятся ближе к ядру. Напротив, если заряд ядра увеличивается, то радиус атома увеличивается, так как электроны будут находиться на большем расстоянии от ядра.
Таким образом, заряд ядра играет важную роль в определении радиуса атома и его химических свойств. Чем сильнее заряд ядра, тем более электроны будут притягиваться к нему, в результате чего атом станет меньше. В то же время, слабый заряд ядра позволяет электронам находиться на большем расстоянии от ядра, что приводит к увеличению радиуса атома.
Валентная электронная конфигурация

Понимание валентной электронной конфигурации позволяет объяснить ряд свойств и химических реакций элементов. Элементы с одинаковой валентной электронной конфигурацией обладают схожими химическими свойствами и могут образовывать подобные соединения.
Например, элементы группы 1 (щелочные металлы) имеют один валентный электрон в своей внешней оболочке и легко отдают его, чтобы образовать положительный ион. В то же время, элементы группы 17 (галогены) имеют семь электронов в валентной оболочке и легко принимают один электрон, чтобы образовать отрицательный ион.
Знание валентной электронной конфигурации помогает предсказывать возможные соединения элементов, а также понять и объяснить различные физические и химические свойства веществ. Это один из ключевых факторов, влияющих на радиус атома, так как количество и распределение валентных электронов определяет размер атома и его взаимодействие с другими атомами.
Влияние ионной связи
В ионной связи радиус катиона, образовавшегося за счет потери электронов, становится меньше ионного радиуса этого атома. Это происходит из-за уменьшения отталкивающих электронных облаков и следствии увеличения притяжения катиона и аниона. В то же время радиус аниона, получившего электроны, становится больше ионного радиуса этого атома, что происходит из-за увеличения отталкивающих электронных облаков аниона.
Влияние ионной связи на радиус атома является динамическим процессом, который зависит от условий окружающей среды и химической природы элементов. Ионная связь может влиять на размер атома как в положительную, так и в отрицательную сторону, в зависимости от энергетических условий и характеристик атомов, образующих связь.
Размер атома и его химические свойства

Размер атома играет важную роль в его химических свойствах. Чем больше атом, тем больше электронных облаков у него будет, а значит, больше электронных облаков для взаимодействия с другими атомами. Поэтому атомы большего размера будут иметь большую реакционную способность.
Кроме того, радиус атома также влияет на его электронную конфигурацию, что, в свою очередь, определяет его химические свойства. Например, маленький размер атома может означать большую электроотрицательность, так как электроны располагаются близко к ядру и сильнее притягиваются к нему. С другой стороны, больший размер атома может привести к меньшей электроотрицательности.
Кроме размера атома, его химические свойства также зависят от других факторов, таких как заряд ядра, количество электронов и их распределение. Например, атомы с большим числом электронов будут иметь большую реакционную способность, так как у них будет больше возможностей для образования химических связей. Также, заряд ядра может влиять на электронную конфигурацию и химические свойства атома.
В целом, размер атома – это важный фактор, который определяет его химические свойства. Он влияет на реакционную способность атома, его электронную конфигурацию, электроотрицательность и другие свойства. Поэтому понимание радиуса атома помогает в объяснении и предсказании химической активности различных элементов.
Влияние подвижности электронов на радиус атома
Когда электрон находится на своей орбитали, он создает электронную облако, которое приближенно определяет границу атома. Чем больше вероятность обнаружить электрон в определенной области пространства, тем больше радиус атома.
Однако, подвижность электронов в атоме может быть ограничена различными факторами. Во-первых, электроны находятся под влиянием электростатического притяжения к ядру и другим электронам. Чем сильнее притяжение, тем меньше возможность электронам перемещаться далеко от ядра, что приводит к уменьшению радиуса атома.
Кроме того, на подвижность электронов влияет и эффект затухания, вызванный взаимодействием электронов между собой. Электроны отталкиваются друг от друга и приобретают более высокую энергию, что делает их менее подвижными. В результате, радиус атома может быть снижен.
Влияние подвижности электронов на радиус атома может быть также связано с внешними факторами, такими как температура и давление. При повышении температуры электроны приобретают большую энергию и становятся более подвижными, что может привести к увеличению радиуса атома. Также, при повышении давления электроны сжимаются ближе к ядру, что также может сказаться на радиусе атома.
Влияние внешней среды на размер атома

Радиус атома, как важный параметр атомной структуры, может быть подвержен влиянию внешней среды. Размер атома зависит от физических и химических условий окружающей среды, в которой он находится.
Первый фактор, влияющий на размер атома, - это валентность атома. Валентность определяет число связей, которые может образовать атом, и, следовательно, его радиус. Атомы с меньшей валентностью имеют больший радиус, так как у них больше электронных оболочек и менее сжатая электронная плотность.
Второй фактор - электронная плотность. Внешняя среда может влиять на количество электронов и их плотность внутри атома. Например, атомы, находящиеся в сильно ионизованной среде, могут иметь более плотные электронные оболочки и меньший радиус.
Третий фактор - давление. При повышенном давлении атомы становятся более сжатыми и их радиус уменьшается. Это связано с изменением расстояния между ядрами атомов и сжатием электронных облаков.
Кроме того, влияние на размер атома может оказывать и температура окружающей среды. При повышенной температуре атомы могут иметь больший радиус из-за увеличения колебаний электронов и ядер.
Таким образом, внешняя среда может значительно влиять на размер атома, что имеет важные последствия для его химического поведения и взаимодействия с другими атомами.



