Термодинамическая константа равновесия является важным понятием в химии, определяющим направление и степень химической реакции. Она выражает отношение концентраций реагентов и продуктов в равновесном состоянии и зависит от ряда факторов. Однако есть определенные факторы, которые не влияют на термодинамическую константу равновесия.
Представим, что у нас есть химическая реакция, в которой участвуют различные вещества. Согласно принципу Ле Шателье, равновесное состояние изменяется только при изменении одного или нескольких факторов, которые на него влияют. Однако, есть несколько факторов, которые не влияют на термодинамическую константу равновесия.
Во-первых, масса вещества, участвующего в реакции, не оказывает прямого влияния на термодинамическую константу равновесия. Масса может изменяться, но это не изменит соотношение между концентрациями реагентов и продуктов в равновесном состоянии.
Во-вторых, другие химические реакции, которые происходят в системе, также не влияют на термодинамическую константу равновесия. Константа равновесия зависит только от концентраций реагентов и продуктов в определенном состоянии, и она не меняется при выполнении других химических реакций.
Физические свойства вещества

Одним из основных физических свойств вещества является его фазовый состав. Вещество может существовать в разных фазах, таких как твердая, жидкая или газообразная. Фазовые переходы между этими состояниями происходят при определенных условиях температуры и давления.
Температура является еще одним важным физическим свойством вещества. Она определяет степень нагрева или охлаждения вещества и может влиять на его фазовый состав и реакционную способность.
Другие физические свойства вещества включают плотность, вязкость, поверхностное натяжение, теплоемкость и теплопроводность. Эти свойства указывают на физическую структуру и взаимодействие частиц вещества.
Оптические свойства, такие как прозрачность, показатель преломления и цвет, также влияют на взаимодействие вещества с электромагнитным излучением и могут быть использованы для его идентификации и анализа.
Распределение размеров частиц, массовая концентрация и растворимость также относятся к физическим свойствам вещества. Они определяют его физико-химические характеристики и могут влиять на его поведение в различных условиях.
Понимание и изучение физических свойств вещества позволяет углубить наше знание о его поведении и взаимодействии с окружающей средой. Это важно для различных областей науки и техники, включая химию, физику, материаловедение и биологию.
Температура реакции
При повышении температуры реакция протекает быстрее, так как повышается средняя кинетическая энергия молекул, что облегчает схождение коллизионных теоретически вероятных столкновений молекул. Понижение температуры приводит к обратному эффекту и замедлению реакции.
Однако изменение температуры не влияет на значение термодинамической константы равновесия. Термодинамическая константа зависит только от разницы в свободной энергии между реагентами и продуктами реакции и не меняется при изменении температуры. Однако, при повышении или понижении температуры изменяются концентрации реагентов и продуктов, что влияет на положение равновесия.
Для реакций, проходящих с поглощением или выделением тепла, изменение температуры может оказывать существенный эффект на положение равновесия. При повышении температуры эндотермические реакции идут в направлении образования продуктов, в то время как экзотермические реакции будут идти в обратном направлении. Понижение температуры, наоборот, приведет к сдвигу равновесия в обратном направлении для эндотермических реакций и в направлении образования реагентов в экзотермических реакциях.
| Температура | Скорость реакции | Положение равновесия |
|---|---|---|
| Повышение | Увеличивается | Не меняется |
| Понижение | Уменьшается | Не меняется |
Распределение реакционных компонентов
При изучении равновесия химической реакции важно учитывать распределение реакционных компонентов в системе. Распределение реакционных компонентов может зависеть от различных факторов и условий, но не оказывает прямого влияния на термодинамическую константу равновесия.
Например, в реакции газов могут присутствовать разные компоненты, которые могут находиться в различных фазах (газообразной или жидкой). Распределение газовых компонентов может быть определено их давлением, температурой и взаимодействием с другими веществами в системе.
Распределение реакционных компонентов также может быть связано с их растворимостью в реакционной среде. Например, в растворе могут присутствовать разные ионы, которые могут находиться в разных концентрациях в зависимости от химического равновесия.
| Компонент | Распределение | Факторы влияния |
|---|---|---|
| Газовые компоненты | Распределение давлений | Температура, объем, взаимодействие с другими веществами |
| Растворенные ионы | Распределение концентраций | Растворимость, концентрация реакционных компонентов, pH |
Изучение распределения реакционных компонентов позволяет более полно понять механизм и условия протекания химической реакции, однако оно не влияет на термодинамическую константу равновесия, которая определяет степень протекания реакции при заданных условиях.
Давление среды
Термодинамическая константа равновесия зависит только от температуры и концентрации реагентов. Изменение давления не вызывает сдвиг равновесия в направлении увеличения концентрации определенного вещества или повышения или понижения температуры системы.
Однако, изменение давления может влиять на скорость реакции. Повышение давления может увеличить количество столкновений между молекулами реагентов, что может привести к ускорению реакции.
Осознание того, что давление среды не влияет на термодинамическую константу равновесия, является важным для понимания и прогнозирования поведения химических реакций и состояний равновесия систем.
Концентрация реакционных компонентов

Концентрация реакционных компонентов может влиять на скорость протекания реакции, но не на положение равновесия. При изменении концентрации одного реагента или продукта, система смещается в направлении, которое позволяет ей достичь нового равновесия. Это называется принципом Ле Шателье.
Изменение концентрации реагентов или продуктов может оказывать влияние на равновесное распределение между реагентами и продуктами. Если концентрация одного из компонентов увеличивается, то равновесие смещается в сторону увеличения концентрации продуктов, чтобы компенсировать это изменение. В случае уменьшения концентрации одного из компонентов, равновесие смещается в сторону увеличения концентрации реагентов.
Однако, вне зависимости от изменения концентрации, термодинамическая константа равновесия остается постоянной. Это означает, что при заданной температуре и энергетических параметрах реакции, равновесное соотношение реагентов и продуктов остается неизменным даже при изменении концентраций.
Катализаторы и ингибиторы

Катализаторы - это вещества, которые ускоряют химическую реакцию, но не расходуются в процессе. Они позволяют снизить энергию активации, необходимую для начала реакции, путем предоставления альтернативного пути реакции с более низкой энергией активации. Катализаторы могут повысить скорость реакции, облегчить обратимую реакцию или изменить селективность реакции.
Ингибиторы, напротив, замедляют химическую реакцию или предотвращают ее совершение. Они могут препятствовать поступлению реагентов на активные центры реакционного места или связываться с активными центрами, блокируя доступ реагентов. Ингибиторы широко используются в медицине и промышленности для контроля химических реакций и предотвращения нежелательных процессов.
| Катализаторы | Ингибиторы |
|---|---|
| Ускоряют реакцию | Замедляют реакцию |
| Не расходуются в процессе реакции | Обратимые или необратимые |
| Могут повышать селективность реакции | Могут предотвращать нежелательные реакции |
| Могут изменять механизм реакции | Могут связываться с активными центрами |
Катализаторы и ингибиторы представляют собой важные инструменты для управления и контроля химических реакций, однако они не влияют на термодинамическую константу равновесия, которая определяется тепловыми вкладами и концентрацией реагентов и продуктов.
Масса реакционной смеси

Масса реакционной смеси не влияет на термодинамическую константу равновесия реакции. Это означает, что изменение массы смеси не приведет к изменению равновесной концентрации реагентов и продуктов.
Термодинамическая константа равновесия реакции определяется только температурой и составом реагентов. Она показывает, в каком направлении будет происходить реакция при заданных условиях.
Масса реакционной смеси может влиять на скорость реакции или на количество получаемого продукта, но она не будет иметь никакого влияния на равновесие реакции.
Для достижения равновесия реакции можно изменять другие факторы, такие как концентрация, давление или температура. Однако масса реакционной смеси не будет играть роли в этом процессе.
Влияние окружающей среды

Окружающая среда может оказывать влияние на термодинамическую константу равновесия реакции. Некоторые факторы окружающей среды могут изменять условия, при которых происходит реакция, что может привести к изменению равновесия.
Один из факторов окружающей среды, который может влиять на термодинамическую константу равновесия, - это температура. Повышение температуры может способствовать сдвигу равновесия реакции в ту сторону, в которой происходит поглощение тепла, чтобы компенсировать внешнее повышение температуры. Напротив, снижение температуры может способствовать сдвигу равновесия в ту сторону, в которой происходит выделение тепла.
Другим фактором окружающей среды, влияющим на термодинамическую константу равновесия, является давление. Изменение давления может изменять объем газовой фазы системы, а это в свою очередь может повлиять на концентрацию компонентов и направление процесса.
Также следует отметить, что присутствие различных веществ в окружающей среде может оказывать катализирующее или ингибирующее воздействие на реакцию. Это связано с изменением активации реакции и скорости процесса.
В общем, окружающая среда имеет значительное влияние на термодинамическую константу равновесия реакции и может изменять условия, при которых происходит реакция.
| Окружающая среда | Влияние на равновесие |
|---|---|
| Высокая температура | Сдвиг равновесия в сторону поглощения тепла |
| Низкая температура | Сдвиг равновесия в сторону выделения тепла |
| Высокое давление | Изменение объема газовой фазы системы |
| Присутствие катализаторов | Увеличение скорости реакции |
Фазовые превращения
Существуют три основных типа фазовых превращений: испарение, кристаллизация и плавление. Испарение происходит при переходе вещества из жидкой фазы в газообразную. Кристаллизация – это обратный процесс, при котором газообразное или жидкое вещество превращается в твердое. При плавлении твердое вещество переходит в жидкое состояние.
Фазовые превращения основаны на изменении энергии и взаимодействии между молекулами вещества. В твердом состоянии молекулы находятся близко друг к другу и имеют низкую энергию. В жидком состоянии молекулы движутся свободно, но все еще сильно связаны. В газообразном состоянии молекулы движутся быстро и свободно, и их энергия наиболее высокая.
Фазовые превращения могут происходить как при повышении, так и при понижении температуры и давления. Например, при повышении температуры жидкость может испаряться, а при понижении твердое вещество может плавиться. Фазовые превращения также могут зависеть от наличия или отсутствия катализаторов и растворителей.
Важно отметить, что фазовые превращения не зависят от термодинамической константы равновесия. Термодинамическая константа равновесия определяется только температурой и составом системы, но не зависит от фазовых превращений.
Постоянные физические условия
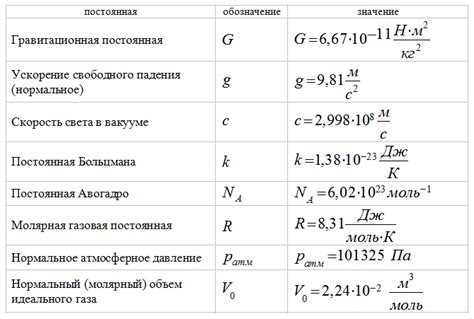
Поскольку термодинамическая константа равновесия определяет состояние равновесия системы, она зависит от ряда условий, которые не подвержены изменениям или факторам, которые не имеют прямого влияния на эту константу. Такие условия называются постоянными физическими условиями.
Первым постоянным физическим условием является атмосферное давление. Влияние давления на термодинамическую константу равновесия обычно незначительно и не учитывается при расчетах.
Вторым постоянным физическим условием является физический объем системы. Величина и форма объема могут изменяться, но для расчетов термодинамической константы равновесия все равно используется исходный физический объем системы.
Третьим постоянным физическим условием является атмосферная влажность. Воздействие влажности на термодинамическую константу равновесия также незначительно и обычно не учитывается при расчетах.
И наконец, четвертым постоянным физическим условием является физическое состояние окружающей среды. Он может быть изменен различными факторами, такими как температура, влажность и давление, однако для расчетов термодинамической константы равновесия используется исходное физическое состояние.
Таким образом, постоянные физические условия не имеют прямого влияния на термодинамическую константу равновесия, и их влияние обычно не учитывается при расчетах.



