Энергетический уровень атома – это основополагающее понятие в химии, которое помогает нам понять и объяснить поведение атомов и молекул. Энергетический уровень представляет собой конкретное значение энергии, которую атом может иметь в определенном квантовом состоянии.
Атомы могут находиться на разных энергетических уровнях, которые отражают количественное значение их энергии. Каждый энергетический уровень связан с квантовыми числами, такими как главное квантовое число, орбитальное квантовое число и магнитное квантовое число. Эти числа определяют взаимодействие атома с электромагнитным полем и определяют его энергетическое состояние.
Электроны, находясь вокруг атомного ядра, могут занимать различные энергетические уровни. Изменение энергетического уровня электрона происходит при поглощении или испускании энергии в виде фотонов. Совокупность энергетических уровней электронов образует энергетические уровни атома, которые определяют его электронную структуру и реакционную способность.
Изучение энергетических уровней атома важно для понимания химических реакций, анализа атомно-молекулярных систем и создания новых материалов. Изменение энергетических уровней атомов позволяет нам контролировать и использовать их свойства в различных приложениях, таких как катализ, фотоэлектрические ячейки и квантовые компьютеры.
Определение энергетического уровня атома в химии

У атома могут быть несколько энергетических уровней, обозначаемых числами n = 1, 2, 3 и т.д. Первый энергетический уровень, n = 1, находится ближе всего к ядру и имеет наименьшую энергию. Соответственно, с увеличением числа n энергия энергетического уровня возрастает.
На каждом энергетическом уровне могут находиться определенное количество электронов. По правилу Клетчатой модели, на первом энергетическом уровне может находиться максимум 2 электрона, на втором - 8 электронов, на третьем - 18 и так далее. Это связано с тем, что каждый энергетический уровень имеет свои орбитали, на которых могут располагаться электроны.
Переход электрона между энергетическими уровнями происходит при поглощении или излучении энергии, например, при взаимодействии с фотоном или при воздействии внешнего электромагнитного поля.
| Энергетический уровень | Число электронов |
|---|---|
| n = 1 | 2 |
| n = 2 | 8 |
| n = 3 | 18 |
Энергетические уровни атома - важное понятие в химии, так как они определяют не только физические и химические свойства веществ, но и возможность для возникновения различных реакций и соединений.
Энергетический уровень: сущность и значение
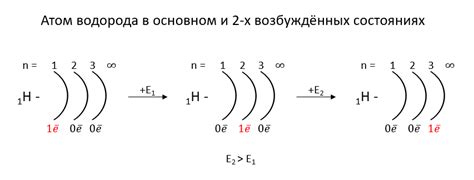
Энергетический уровень в химии представляет собой физический параметр, который описывает энергетическое состояние атома. Он указывает на распределение электронов в атоме и позволяет определить, на каких уровнях энергии находятся электроны.
Атом состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, которое окружает ядро. Энергетические уровни атома представляют собой дискретные значения энергии, на которых могут находиться электроны. Каждый уровень имеет свою определенную энергию, характеризующуюся определенным числом энергетических единиц.
Наиболее низкий энергетический уровень называется основным состоянием атома. Электроны, расположенные на этом уровне, наиболее плотно связаны с ядром и обладают наименьшей энергией. Другие энергетические уровни, которые находятся выше основного состояния, называются возбужденными состояниями. На этих уровнях электроны обладают большей энергией и могут переходить на другие уровни путем поглощения или испускания энергии в форме фотонов.
Значение энергетического уровня атома заключается в том, что оно определяет его физические и химические свойства. Энергетические уровни влияют на термохимические и кинетические процессы, такие, как тепловые реакции, спектральные характеристики и химические связи. Кроме того, энергетические уровни являются основой для понимания и описания атомных и молекулярных структур, что важно при изучении химической реактивности и создании новых материалов.
Основные типы энергетических уровней
Энергетические уровни атома характеризуют состояния энергии, в которых находятся его электроны. В химии существует несколько основных типов энергетических уровней.
1. Основной энергетический уровень: на нем находится самый ближайший к ядру электрон. Уровень имеет наименьшую энергию и обозначается как n=1. Все остальные энергетические уровни отсчитываются от него.
2. Вторичные энергетические уровни: это уровни, которые находятся на большем расстоянии от ядра, чем основной уровень. Их энергия выше, чем у основного уровня, и они обозначаются как n=2, n=3 и т.д. Чем больше число n, тем выше энергетический уровень.
3. Субуровни: внутри каждого энергетического уровня существуют подуровни, обозначаемые буквами s, p, d, f. Каждый подуровень может содержать определенное число электронов. Например, основной уровень содержит только один подуровень s, а вторичные уровни могут содержать подуровни s и p.
4. Орбитали: орбитали представляют собой пространственные области вокруг ядра, где находятся электроны. Каждая орбиталь может содержать до двух электронов разных спиновых состояний.
Наличие различных энергетических уровней и подуровней в атоме обусловливает его химические свойства и способность вступать в химические реакции. Понимание этих уровней помогает исследователям, изучающим строение и свойства атомов, понять и объяснить различные химические явления и закономерности.
Важность энергетического уровня для атома

Энергетический уровень атома играет важную роль в химии и физике. Он определяет, какие энергии могут быть "разрешены" для электронов, находящихся вокруг атома. Изменение энергетического уровня атома может привести к изменению его химических свойств и способности взаимодействовать с другими атомами.
Наименьшая энергия, которую может иметь электрон в атоме, называется основным энергетическим уровнем или уровнем нулевого возбуждения. Она определяется энергией электронного облака атома и может принимать дискретные значения. Каждый энергетический уровень может вместить определенное количество электронов.
Высшие энергетические уровни, также называемые возбужденными уровнями, имеют большую энергию, чем основной уровень. Когда атом получает энергию, электроны могут переходить на более высокие уровни. При возврате на основной уровень электроны излучают энергию в виде света или других форм электромагнитного излучения.
Важность энергетического уровня заключается в том, что он определяет способность атома вступать в химические реакции. Энергия электронов на энергетическом уровне определяет их силу притяжения к ядру атома и их взаимодействие с другими атомами. Более высокие энергетические уровни могут позволять атому образовывать новые связи и участвовать в сложных реакциях, в то время как энергетические уровни, близкие к основному, могут уменьшать его реакционную активность.
Изучение энергетического уровня атомов помогает понять и предсказать их химическое поведение. Оно также является важным для развития новых материалов, технологий и прогнозирования свойств различных веществ. Поэтому понимание взаимосвязи между энергетическим уровнем атома и его химическими свойствами играет значительную роль в современной науке и технологии.
Квантовая механика и энергетические уровни

Атомы могут пребывать в различных энергетических состояниях, которые называются энергетическими уровнями. Квантовая механика описывает эти уровни с помощью математического формализма, известного как волновая функция. Волновая функция определяет вероятность нахождения частицы в определенном состоянии и позволяет предсказать энергетический спектр атома.
Из-за квантовой природы энергии, энергетические уровни атомов являются дискретными. Это означает, что атом может принимать только определенные значения энергии, которые соответствуют различным микро-состояниям системы. Каждый энергетический уровень имеет свою уникальную энергию и квантовые числа, которые определяют размер и форму орбитали, на которой находится электрон.
Таблица ниже представляет первые несколько энергетических уровней атома водорода:
| Энергетический уровень | Главное квантовое число, n | Энергия (в электрон-вольтах) |
|---|---|---|
| 1s | 1 | -13.6 |
| 2s | 2 | -3.4 |
| 2p | 2 | -3.4 |
| 3s | 3 | -1.5 |
| 3p | 3 | -1.5 |
Как видно из таблицы, энергия атома водорода становится все более отрицательной с увеличением главного квантового числа. Это означает, что энергетический уровень 1s является самым низким, а уровни 2s, 2p, 3s, 3p имеют более высокую энергию.
Изучение энергетических уровней атомов позволяет химикам понять, как происходят химические реакции, какие энергетические переходы могут происходить между уровнями и какие свойства атомов определяются их энергетическим состоянием. Это имеет фундаментальное значение при изучении химической связи, взаимодействия атомов и молекул, и применении этих знаний в различных областях химии и материаловедения.
Как определяется энергетический уровень атома
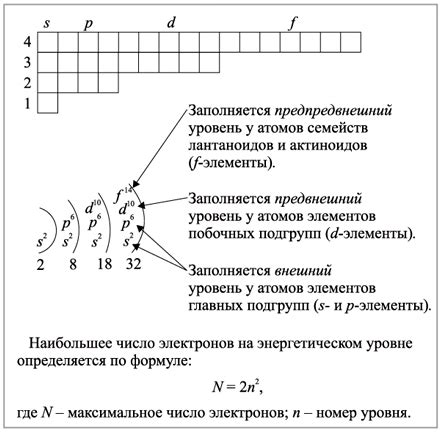
Энергетический уровень атома, также известный как энергетический уровень электрона, определяется его энергией. Атом состоит из ядра, которое содержит протоны и нейтроны, и электронов, которые обращаются вокруг ядра на определенных энергетических уровнях.
Каждый энергетический уровень атома имеет определенную энергию. Наиболее близкий к ядру энергетический уровень имеет самую низкую энергию и называется основным. Выше основного находятся возбужденные энергетические уровни, имеющие более высокую энергию.
Энергетический уровень атома определяется его электронной конфигурацией, то есть распределением электронов по энергетическим уровням. Каждый энергетический уровень имеет ограниченную емкость, то есть может вместить определенное количество электронов.
Определение энергетического уровня атома включает изучение энергетических уровней и их соответствующих энергий, а также электронной конфигурации атома. Уровень энергии электрона может быть определен с помощью различных экспериментальных методов, включая спектроскопию, масс-спектрометрию и расчеты на основе квантовой механики.
Знание энергетических уровней атома и их энергий позволяет понять и объяснить химические свойства атома, его способность взаимодействовать с другими атомами и образовывать химические связи.
Взаимосвязь энергетических уровней и химических свойств
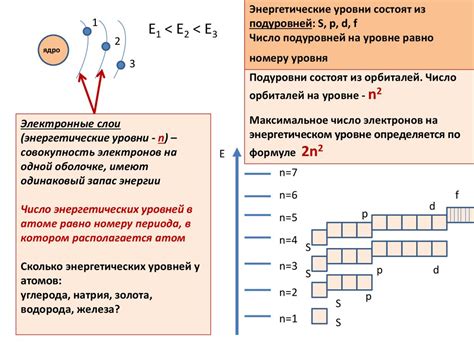
Энергетические уровни атома играют важную роль в определении его химических свойств. Химические реакции происходят, когда энергия атомов изменяется, взаимодействуя с энергией окружающей среды.
Наиболее низкий энергетический уровень атома, называемый основным состоянием, определяет его стабильность и химическую активность. Энергия, необходимая для перемещения атома на более высокий энергетический уровень, может быть поставлена в соответствие определенной реакционной барьерной энергии. Эта энергия определяет вероятность совершения химической реакции.
Не только энергетический уровень атома, но и разность между энергетическими уровнями разных атомов может оказать влияние на химические свойства вещества. Если разница в энергии между энергетическими уровнями двух атомов сильно отличается, возникает электронный перенос и образуются ионные связи. Если разница незначительна, образуются атомные связи.
Кроме того, энергетические уровни могут повлиять на электронную структуру атома и его способность к химическим реакциям. Атомы с энергетическими уровнями, заполненными электронами, обычно более стабильны и менее склонны участвовать в химических реакциях, чем те атомы, у которых энергетические уровни не заполнены полностью.
Таким образом, энергетические уровни атома играют важную роль в его химической активности и влияют на химические свойства вещества. Понимание этих взаимосвязей позволяет ученым предсказывать и объяснять различные химические явления, а также создавать новые материалы с определенными химическими свойствами.
Первые энергетические уровни атома в периодической системе
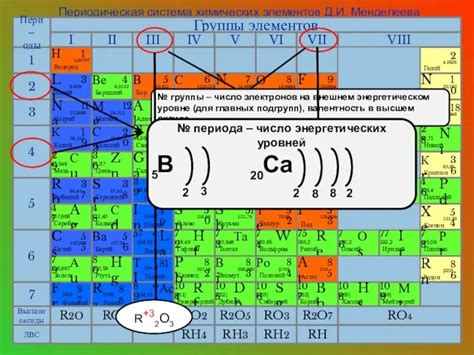
Первые энергетические уровни атома находятся на наименьшем расстоянии от ядра и имеют самую низкую энергию. В периодической системе элементов они соответствуют первой энергетической оболочке.
В первой энергетической оболочке могут находиться не более двух электронов. Она состоит из двух подуровней - s и p. Подуровень s может содержать только одну пару электронов, а подуровень p - до шести электронов.
Подуровень s регулярно заполняется и состоит из одного атомного орбиталя. На нем могут находиться только два электрона с противоположными спинами.
Подуровень p состоит из трех атомных орбиталей - px, py и pz. Он может вмещать до шести электронов, располагая каждый электрон на одном из орбиталей.
На первых энергетических уровнях атома находятся элементы первого периода периодической системы. Это водород (H) и гелий (He). Водород имеет один электрон на первом энергетическом уровне, а гелий - два электрона, при этом первый электрон занимает орбиталь s, и второй - орбиталь s и орбиталь p.
Знание энергетических уровней атома позволяет понять его строение и свойства. Они играют важную роль в объяснении химических реакций и взаимодействий атомов, а также в определении электронной структуры элементов периодической системы.
Изменение энергетического уровня при взаимодействии с другими атомами

Энергетический уровень атома определяет его электронную структуру и его способность образовывать химические связи. При взаимодействии с другими атомами энергетический уровень атома может изменяться, что приводит к образованию новых химических соединений.
В химии существуют два основных понятия, связанных с изменением энергетического уровня атома при взаимодействии с другими атомами: ионизация и эксцитация.
Ионизация – это процесс, в результате которого атом или молекула теряет или приобретает один или несколько электронов. При ионизации энергетический уровень атома может изменяться, в зависимости от того, сколько энергии требуется для отделения электронов или их приобретения. Ионизация может происходить в результате взаимодействия с другими атомами, а также под воздействием электромагнитного излучения.
Эксцитация – это процесс, при котором атом или молекула поглощает энергию и переходит на более высокий энергетический уровень. При эксцитации электрон в атоме может перейти на более высокий энергетический уровень, атом может вращаться или колебаться с большей амплитудой. Эксцитация может происходить под воздействием электромагнитного излучения или в результате взаимодействия с другими атомами.
| Тип взаимодействия | Изменение энергетического уровня |
|---|---|
| Ионизация | Потеря или приобретение электронов |
| Эксцитация | Переход на более высокий энергетический уровень |
Изменение энергетического уровня атома при взаимодействии с другими атомами является основой химических реакций. Это позволяет формировать новые связи, образовывать стабильные соединения и обеспечивать разнообразие химических процессов.
Роль энергетического уровня в определении спектральных линий
Каждая спектральная линия соответствует переходу электронов между энергетическими уровнями в атоме. Когда электрон переходит с более высокого энергетического уровня на более низкий, он излучает фотон света определенной длины волнового спектра. Если электрон поглощает фотон света определенной длины волнового спектра, он переходит с низкого энергетического уровня на высокий.
Таким образом, энергетические уровни атома определяют энергию перехода электрона, что в свою очередь определяет длину волнового спектра излучаемого или поглощаемого света. Каждый атом имеет уникальный набор энергетических уровней, поэтому каждый атом излучает или поглощает свет с уникальным спектром. Изучение спектральных линий позволяет узнать о составе и структуре вещества.



