Электронный слой или энергетический уровень - это модель атома, которая помогает нам представить распределение электронов вокруг ядра атома. Каждый атом имеет определенное количество электронов, и они могут находиться на разных энергетических уровнях или слоях.
Эти энергетические уровни расположены по возрастающей энергии, причем каждый уровень может содержать определенное количество электронов. Наиболее близкий к ядру атома уровень называется первым энергетическим уровнем или первым слоем. Каждый следующий уровень имеет большую энергию и называется вторым, третьим и т.д. энергетическими уровнями.
На энергетическом уровне электроны располагаются в атоме соответствующим образом. Каждый электрон занимает определенное место на своем уровне и в своей области пространства, называемой орбиталью. Орбитали могут иметь различную форму и ориентацию, и это влияет на взаимодействие электронов в атоме.
Значение электронного слоя в атоме
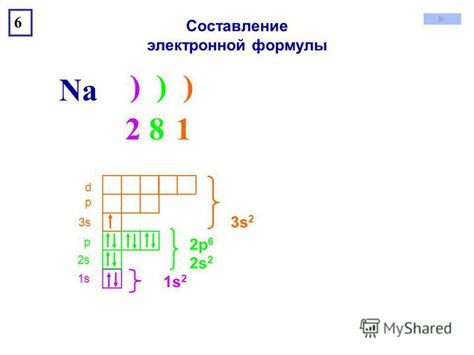
Значение электронного слоя в атоме состоит в том, что он определяет электронную конфигурацию атома и химические свойства элемента. Каждый электронный слой может содержать определенное число электронов, и они заполняются в порядке возрастания энергии.
На электронном слое электроны находятся в движении вокруг ядра атома и формируют облако электронной плотности. Энергетические уровни, на которых расположены электронные слои, обозначаются целыми числами, начиная от первого уровня, ближайшего к ядру.
Расположение электронов на разных энергетических уровнях влияет на связывание атомов между собой и образование химических соединений. Более близкие к ядру электроны имеют меньшую энергию и сильнее привязаны к атому, в то время как электроны, находящиеся на более удаленных слоях, имеют большую энергию и слабее связаны.
Таким образом, электронный слой в атоме играет важную роль в определении химических свойств элемента и его реакционной способности.
Атом. Состав. Строение.
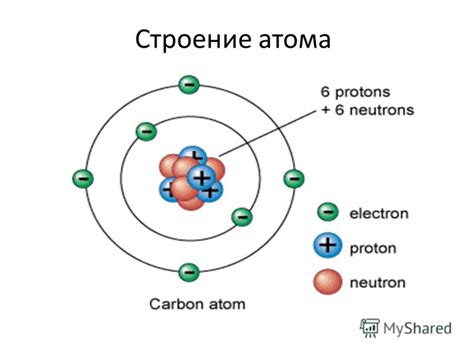
Состав атома определяется числом протонов в ядре. Это число называется атомным номером и является основным свойством химического элемента. Электронное облако состоит из отрицательно заряженных электронов, которые движутся по энергетическим уровням или электронным слоям.
Энергетический уровень - это возможная энергия электрона в атоме. Уровни располагаются на разных расстояниях от ядра и нумеруются числами 1, 2, 3 и т.д. Каждый уровень может содержать определенное количество электронов:
- Первый уровень - может содержать не более 2 электронов.
- Второй и третий уровни - могут содержать не более 8 электронов.
- Четвертый и последующие уровни - также могут содержать не более 8 электронов.
Наиболее близкие к ядру энергетические уровни обладают меньшей энергией, а более удаленные - большей энергией. Электроны могут переходить с одного уровня на другой, поглощая или испуская энергию в виде света.
Электронный слой: определение и функции

Основная функция электронного слоя заключается в том, чтобы удерживать электроны вокруг атомного ядра. Каждый энергетический уровень может содержать определенное количество электронов, которые занимают различные орбитали или подуровни.
Электронные слои имеют различную энергию, и электроны занимают слои с наименьшей энергией в первую очередь, в соответствии с принципом заполнения электронных уровней. Это позволяет атому быть стабильным, поскольку электроны находятся на наиболее низких доступных уровнях энергии.
Кроме того, электронные слои определяют химические свойства атома. Они задают возможные состояния, в которых могут находиться электроны, и влияют на способность атома образовывать химические связи. Количество электронных слоев и распределение электронов по слоям определяют положение атома в периодической системе элементов и его химические свойства.
В общем, электронный слой является основным строительным блоком атома и играет важную роль в его свойствах и взаимодействиях с другими атомами. Понимание электронных слоев помогает расширить наши знания о строении вещества и его поведении в химических реакциях.
Энергетический уровень: классификация
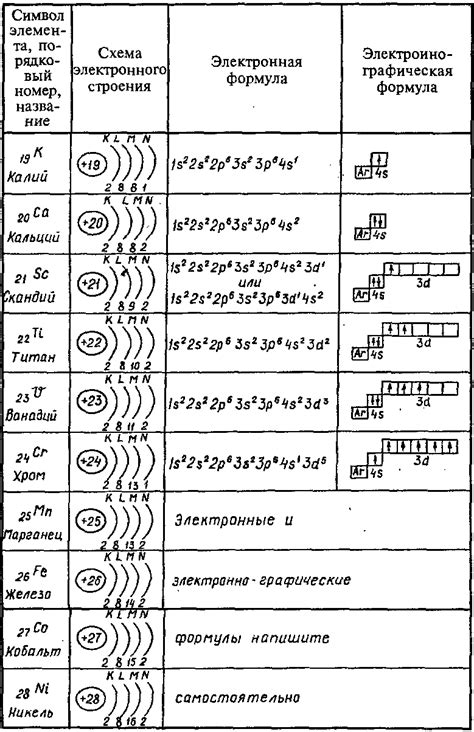
Энергетический уровень, или электронный слой, представляет собой область пространства вокруг атомного ядра, в которой находятся электроны. Все электроны атома распределены по разным энергетическим уровням, которые можно классифицировать на основе их расстояния от ядра и энергии.
Существует несколько способов классификации энергетических уровней:
- Основной (главный) энергетический уровень: обозначается числом n=1, n=2, n=3 и т.д. Чем больше число n, тем дальше энергетический уровень от ядра.
- Подуровни: каждый основной энергетический уровень делится на подуровни, обозначаемые буквами s, p, d, f и т.д. Каждый подуровень вмещает определенное количество электронов.
- Атомные орбитали: каждый подуровень делится на атомные орбитали, обозначаемые числами и буквами. Атомная орбиталь определяет форму и ориентацию электронной оболочки вокруг ядра.
Энергетические уровни атома помогают описывать и предсказывать его свойства и поведение. Понимание классификации энергетических уровней основа для изучения электронной структуры атома и химической связи.
Зависимость состояния электрона от энергетического уровня
Электроны, находящиеся в атоме, могут занимать различные энергетические уровни или электронные слои. Каждый энергетический уровень характеризуется определенным количеством энергии, которую электрон получает при переходе на этот уровень или отдает, когда переходит на более низкий уровень.
В атоме присутствует несколько энергетических уровней, обозначаемых буквами: K, L, M и так далее. Уровень K наименее удален от ядра, а последующие уровни располагаются все дальше от него. Каждый энергетический уровень может вмещать ограниченное количество электронов. Например, уровень K может вместить не более 2-х электронов, а уровень L – не более 8-ми. То есть, электроны располагаются на энергетическом уровне в определенном порядке, начиная с ближайшего к ядру.
Переход электрона с одного энергетического уровеня на другой происходит при поглощении или испускании энергии. Например, если электрон получает достаточно энергии, то он может перейти на более высокий энергетический уровень. Если электрон находится на верхнем энергетическом уровне, то он может испустить избыточную энергию и перейти на более низкий уровень. Часто такие переходы сопровождаются испусканием электромагнитного излучения в виде света.
Таким образом, состояние электрона в атоме зависит от его энергетического уровня. Количество электронов, занимающих каждый уровень, определяет электронную конфигурацию атома, а переходы электронов между уровнями – его химические свойства и способность воздействовать на другие вещества.



