Скорость реакции - одна из важнейших характеристик химической реакции. Она определяет, насколько быстро протекает процесс превращения реагентов в продукты. В химии различают два типа скорости реакции: среднюю и истинную.
Средняя скорость реакции - это равномерное изменение концентрации реагентов или продуктов реакции в течение определенного времени. Она рассчитывается как отношение изменения концентрации вещества к изменению времени. Средняя скорость реакции может быть определена экспериментально путем измерения концентраций вещества в разные моменты времени.
Истинная скорость реакции - это скорость реакции в конкретный момент времени. Она определяется дифференциальным методом, позволяющим найти скорость реакции в каждый момент времени. Истинная скорость реакции может быть различной в разные моменты времени и зависит от множества факторов, таких как концентрация реагентов, температура, давление и наличие катализаторов.
Понимание средней и истинной скорости реакции важно для понимания химических процессов и оптимизации химических реакций. Изучение и контроль скорости реакции позволяют разработать более эффективные способы синтеза химических веществ, улучшить энергетические процессы и реализовать новые технологии. Это делает изучение скорости реакции актуальной и интересной задачей в области химии и науки в целом.
Что такое средняя скорость реакции
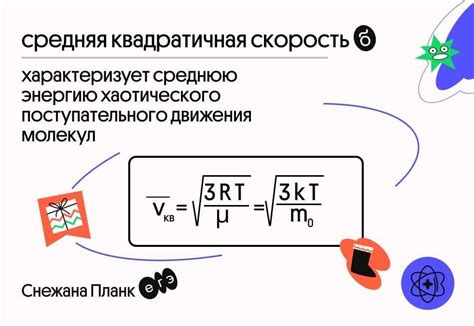
Для определения средней скорости реакции необходимо знать исходные концентрации реагентов, их конечные концентрации и время, за которое происходит реакция.
Средняя скорость реакции может быть положительной, если концентрация продуктов увеличивается со временем, или отрицательной, если концентрация реагентов уменьшается.
Средняя скорость реакции может быть полезна для оценки эффективности химической реакции, определения кинетических характеристик реакции и прогнозирования времени ее окончания.
Важно отметить, что средняя скорость реакции может быть различной в разных условиях, таких как температура, давление, концентрации реагентов и присутствие катализаторов.
Как измеряется средняя скорость реакции

Для измерения средней скорости реакции необходимо установить интервал времени, в течение которого происходит изменение концентрации реагентов или продуктов. Значение концентрации в начале и в конце интервала времени фиксируется при помощи химических анализов или специальных приборов.
Наиболее распространенным способом измерения средней скорости реакции является определение изменения концентрации реагентов или продуктов реакции по ходу времени. Для этого проводятся серия измерений на разных временных промежутках после начала реакции.
Затем полученные данные обрабатываются и позволяют определить среднюю скорость реакции. Обычно она выражается как изменение концентрации реагентов или продуктов реакции в единицу времени.
Для точного измерения средней скорости реакции необходимо учитывать другие факторы, такие как температура и концентрация реагентов, физическое состояние реагентов и наличие катализаторов. Такие факторы могут оказывать значительное влияние на скорость химической реакции и должны быть учтены при проведении эксперимента.
Истинная скорость реакции: понятие и примеры

Примером реакции с известной истинной скоростью является распад радиоактивного вещества. Например, полураспад радиоактивного изотопа урана-238 имеет истинную скорость, измеряемую в единицах времени.
| Вещество | Исходная концентрация, моль/л | Конечная концентрация, моль/л | Время, с | Истинная скорость, моль/л/с |
|---|---|---|---|---|
| Уран-238 | 0.2 | 0.1 | 60 | 0.0017 |
В приведенном примере, истинная скорость реакции равна 0.0017 моль/л/с, что означает, что концентрация урана-238 уменьшается на 0.0017 моль на один литр реакционной смеси за одну секунду.
Строго говоря, в большинстве химических реакций истинная скорость зависит от концентрации реагентов. Таким образом, она может быть определена с использованием математических моделей и уравнений.
Факторы, влияющие на истинную скорость реакции

Истинная скорость реакции определяется не только средней скоростью, но и рядом факторов, которые могут значительно повлиять на процесс реакции. Некоторые из этих факторов включают:
- Концентрация реагентов: Чем выше концентрация реагентов, тем быстрее может протекать реакция. Повышение концентрации увеличивает вероятность столкновения молекул реагентов и, соответственно, увеличивает скорость реакции.
- Температура: Увеличение температуры также увеличивает скорость реакции. При повышении температуры энергия молекул реагентов увеличивается, что способствует ускорению реакции.
- Поверхность контакта: Большая поверхность контакта между реагентами может способствовать увеличению скорости реакции. Например, мелко измельченные или порошкообразные реагенты имеют большую поверхность контакта и, следовательно, их реакция может протекать быстрее.
- Катализаторы: Катализаторы являются веществами, которые ускоряют реакцию, участвуя в ней, но не расходуются при этом. Они могут снизить энергию активации, что способствует увеличению скорости реакции.
- Полярность реакционных сред: Если реагенты имеют разную полярность, это может повлиять на скорость реакции. Реагенты с высокой полярностью могут взаимодействовать быстрее, чем реагенты с низкой полярностью.
- Присутствие растворителя: Растворитель может стабилизировать реагенты и повысить их разрешимость, что в свою очередь может увеличить скорость реакции.
- Давление: Давление может повлиять на скорость реакции, особенно в случае газообразных реагентов. Повышение давления может увеличить вероятность столкновения молекул реагентов и, следовательно, увеличить скорость реакции.
Факторы, влияющие на истинную скорость реакции, могут быть сложными и взаимосвязанными. Их понимание и учет в химических процессах позволяют управлять скоростью реакции и контролировать химические процессы в различных областях науки и техники.



