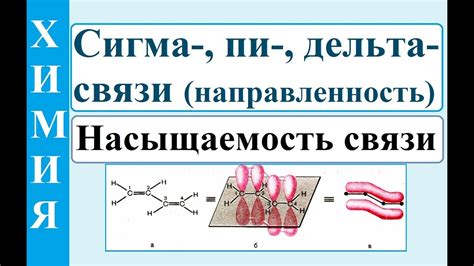
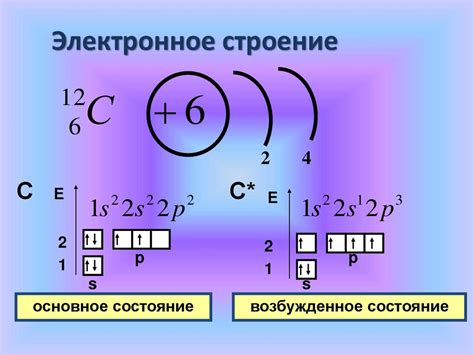
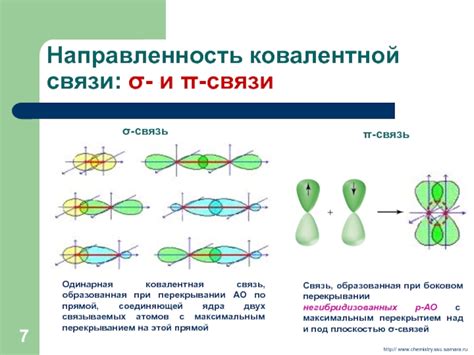
В химии существует несколько видов связей между атомами, одной из которых является пи-связь. Пи-связь представляет собой связь между атомами, которая образуется при перекрытии p-орбиталей атомов. Она играет важную роль в органической химии, определяя реакционную способность и свойства органических соединений.
Особенность пи-связи заключается в том, что она является слабее и более длинной, чем сигма-связь, образуемая при перекрытии s-орбиталей. P-орбитали, участвующие в образовании пи-связи, имеют форму плоского кольца вокруг оси связи. Это приводит к образованию плоскостей симметрии, которые могут допускать движение электронов, что в свою очередь влияет на электронную структуру молекулы.
Примерами соединений, обладающих пи-связью, являются алкены, алкины и ароматические соединения. Алкены - это углеводороды, содержащие двойную связь между углеродными атомами. Пи-связь в алкенах позволяет им проявлять реакционную активность и образовывать сложные молекулы. Алкины - это углеводороды с тройной связью между углеродными атомами. Пи-связь в алкинах обладает еще большей реакционной активностью и может участвовать в дополнительных реакциях.
Определение пи-связи

Пи-связи широко распространены в ароматических соединениях, таких как бензоаты, фенолы и пиридин, а также в молекулах с двойными и тройными связями.
Пи-связи обладают особыми химическими свойствами, такими как конъюгация и сопряженность, которые вносят существенный вклад в реакционную способность органических соединений.
Одним из примеров пи-связи является связь между атомами углерода в бензоле. В бензоле электронные облака пи-связей образуют шестиугольник, что придает этому соединению особую стабильность и ароматность.
Структура пи-связи в химии
Структура пи-связи включает две основные компоненты: пи-орбитали и пи-электроны. Пи-орбитали - это области пространства вокруг атома, где электроны могут находиться при заданных энергиях. Пи-электроны - это электроны, находящиеся в пи-орбиталях.
Пи-орбитали могут быть плоскими или объемными, в зависимости от химической структуры молекулы. В ароматических соединениях, таких как бензол, пи-орбитали формируют беспрерывное кольцо электронов, которое обеспечивает особую стабильность молекулы. В алкенах, пи-орбитали образуют двойную связь.
Пи-электроны перемещаются по пи-орбиталям, создавая электронные облака над и под плоскостью атомных ядер. Это облегчает движение электронов и позволяет молекулам с пи-связью проявлять особые свойства, такие как ароматичность и активность в электрофильных и нуклеофильных атаках.
Примерами молекул с пи-связью являются бензол (C6H6), стилен (C8H8) и олефин (например, этилен, C2H4). В этих молекулах пи-электроны играют важную роль в определении их химических свойств и поведения.
Функция пи-связи в органической химии
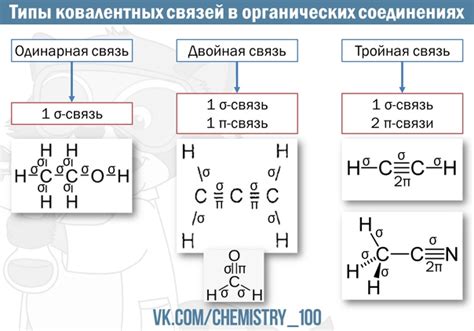
Функция пи-связи в органической химии необходима для обеспечения молекулярной стабильности и устойчивости соединения. Пи-связи играют важную роль в таких процессах, как конъюгация, ароматичность и стабилизация заряда. Они также влияют на физические и химические свойства органических соединений, таких как положение поглотительных максимумов в ультрафиолетовом и видимом спектре, активность соединений в химических реакциях и межмолекулярные взаимодействия.
Одним из примеров пи-связи является двойная связь в алкенах. В алкенах, каждый углеродный атом образует одну сигма-связь с соседним атомом и одну пи-связь. Пи-связь обладает более высокой энергией, чем сигма-связь, и может быть разрываться при поглощении энергии.
Еще одним примером использования пи-связи является образование ароматических соединений, таких как бензол. В бензоле шесть углеродных атомов образуют кольцо, в котором каждый углеродный атом участвует в образовании пи-связи с двумя соседними атомами. Эта пи-связь обеспечивает стабильность кольца и ароматичность соединения.
Таким образом, функция пи-связи в органической химии включает в себя обеспечение молекулярной стабильности, влияние на физические и химические свойства соединений, а также участие в образовании ароматических соединений и конъюгации. Пи-связи имеют важное значение для понимания и изучения органических соединений и их реакций.
Примеры пи-связей в органических соединениях
Вот несколько примеров пи-связей, которые можно найти в органических соединениях:
- Пи-связь в бензоле: бензол - ароматическое соединение, состоящее из шести атомов углерода, соединенных в кольцо. Каждый углеродный атом образует пи-связи с двумя соседними углеродными атомами, образуя плоское шестиугольное кольцо. Эти пи-связи образуют основу ароматического характера бензола.
- Пи-связь в глицине: глицин - простейший аминокислота и строительный блок белков. Он содержит атом углерода, связанный с атомами водорода, аминогруппой и карбоксильной группой. В глицине образуется пи-связь между атомом углерода и амидной группой, придавая молекуле дополнительную устойчивость.
- Пи-связь в эквиноле: эквинол - ароматическое соединение, содержащееся в коже различных животных. Эквинол образует пи-связь между двумя фрагментами молекулы, что способствует его специфическому аромату.
Это лишь несколько примеров пи-связей в органических соединениях. Пи-связи играют важную роль в структурных, электронных и физических свойствах органических соединений, и их понимание является ключевым для понимания многих реакций и явлений в химии органических соединений.
Пи-связь в биологических молекулах
Примером пи-связи в биологических молекулах является взаимодействие ароматических аминокислот в белках. Например, фенилаланин, тирозин и триптофан содержат ароматические кольца, которые могут образовывать пи-связи с другими ароматическими кольцами или с другими молекулами, содержащими ароматическую систему.
Пи-связи могут играть важную роль в стабилизации пространственной структуры белка и взаимодействии между различными функциональными доменами молекулы. Они также могут быть вовлечены в распознавание и связывание лигандов, таких как малые молекулы, нуклеотиды или другие белки.
Пи-связи также встречаются в нуклеиновых кислотах, таких как ДНК и РНК, где ароматические кольца пуриновых и пиримидиновых оснований могут образовывать пи-связи с другими основаниями или с белками, участвующими в процессах репликации, транскрипции и трансляции.
Важно отметить, что пи-связи являются слабыми взаимодействиями и могут быть легко нарушены изменениями в окружающей среде, такими как изменения температуры или pH. Однако, в биологических системах пи-связи играют важную роль в поддержании стабильности и функциональности молекул.
Влияние пи-связи на свойства веществ
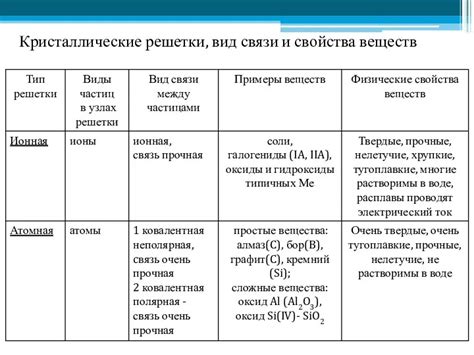
Пи-связь имеет ряд значительных влияний на свойства веществ:
- Способность к проводимости электричества: пи-связь обладает неполярным характером и не образует зарядов, поэтому вещества с пи-связью обычно обладают низкой электропроводностью.
- Свойства оптической активности: некоторые вещества с пи-связью способны разлагаться на два изомера, которые отличаются своей способностью поворачивать плоскость поляризованного света.
- Температурные характеристики: пи-связь может влиять на точку плавления и кипения вещества. Например, пи-связь способна уменьшить межмолекулярные силы притяжения, что снижает температуру плавления и кипения.
- Способность к образованию комплексных соединений: пи-связь может способствовать образованию комплексных соединений, которые имеют особые свойства и применяются в различных областях, например, в катализе и лекарственной химии.
Важно отметить, что влияние пи-связи на свойства веществ может быть различным и зависит от множества факторов, таких как структура молекулы, тип п-облаков и окружающая среда.



