Моль - это одна из основных понятий в химии, которое играет важную роль в понимании и изучении веществ. Некоторым может быть сложно представить себе, что такое моль и зачем она нужна. В этой статье мы разберемся с этими вопросами и постараемся дать понятное объяснение для начинающих.
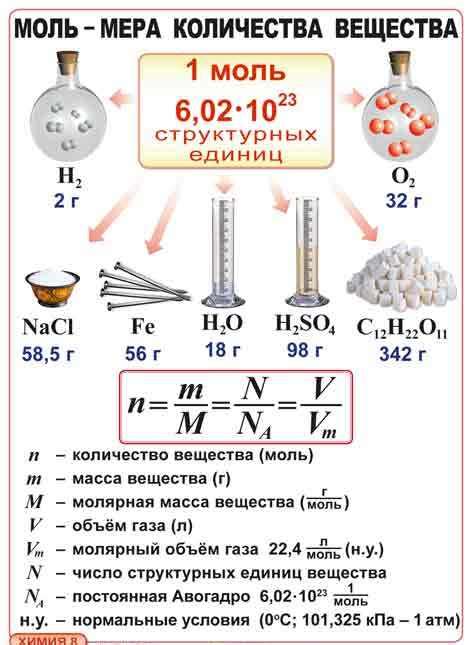
Моль - это количественная единица, с помощью которой измеряются количество вещества. Она является фундаментальным понятием в химических расчетах и позволяет связать массу вещества с количеством его частиц. Одна моль любого вещества содержит определенное количество частиц, которое называется постоянным числом Авогадро.
Постоянное число Авогадро равно примерно 6.022 × 10^23. Это означает, что одна моль любого вещества содержит такое количество частиц, какое обычно содержится в 6.022 × 10^23 атомах, молекулах или ионах этого вещества. Таким образом, молярная масса (масса одной моли вещества) связывает массу вещества с количеством его частиц.
Что такое моль в химии
Одна моль вещества содержит NA частиц, где NA - число Авогадро, примерно равное 6.022×1023. Это число определяет количество частиц в 1 моле вещества.
Моль может быть выражена в различных единицах, например, массой (г/моль), объемом (л/моль), энергией (Дж/моль) и другими величинами.
| Величина | Обозначение |
|---|---|
| Масса одной моли вещества | Молярная масса (M) |
| Объем газа при стандартных условиях | Молярный объем (Vm) |
| Энергия реакции | Молярная энергия (E) |
Понимание понятия моля помогает установить соотношения между различными веществами и определить коэффициенты реакции в уравнениях химических реакций.
Размерность и определение моли
Определение моли: моль - это количество вещества, которое содержит столько же элементарных объектов (атомов, ионов, молекул и т.д.), сколько атомов содержится в 12 граммах углерода-12.
Размерность моли обозначается символом "моль" и является величиной, аналогичной размерности количества предметов. Она является неотъемлемой частью системы СИ (Система Международных Единиц) и является одной из основных единиц в химии.
Одна моль вещества содержит Avogadro's Number (приблизительно 6.022 × 10^23) элементарных объектов. Например, моль кислорода содержит приблизительно 6.022 × 10^23 атомов кислорода.
Моль также позволяет химикам выражать количество вещества в удобных единицах измерения, таких как граммы или литры. Это позволяет проводить расчеты и прогнозировать результаты реакций с большой точностью.
Использование моли как единицы измерения позволяет сравнивать различные вещества и реакции на основе количества элементарных объектов, что делает ее важным инструментом в химии.
Значение моли в химических реакциях

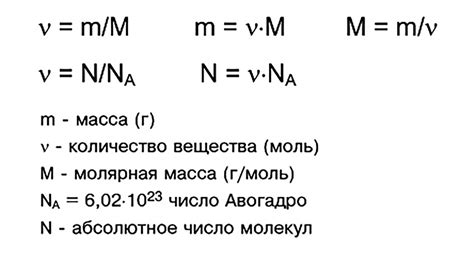
Количество вещества, выраженное в молях, обозначается символом "n". Одна моль вещества содержит Авогадро число единичных частиц, к которым относятся атомы, ионы или молекулы. Авогадро число равно приблизительно 6,022 × 10²³ частиц на одну моль.
Моль представляет собой связующее звено между макроскопическими и микроскопическими аспектами химии. При расчете количества реагентов и продуктов в химической реакции используется понятие стехиометрического коэффициента, который показывает, в каких пропорциях реагенты вступают в реакцию и образуют продукты.
Стехиометрический коэффициент для каждого вещества в химической реакции указывает, какое количество молей данного вещества участвует в реакции. Например, если в химическом уравнении указан коэффициент перед водой (Н₂О) равным 2, это означает, что в реакции участвует 2 моля воды.
Зная количество молей реагентов, можно определить количество молей продуктов и наоборот. Для этого необходимо знать стехиометрические коэффициенты и выполнять простые математические операции.
Применение концепции моли в химических реакциях позволяет оптимизировать процесс синтеза веществ, контролировать концентрацию реагентов и получать максимальное количество продуктов. Также моль является важным понятием для понимания физических и химических свойств вещества.
Мольные массы и мольный объем

Мольная масса – это масса одного моля любого химического соединения. Она измеряется в граммах на моль (г/моль). Молярная масса определяется путем сложения атомных масс всех атомов в молекуле соединения.
Молярная масса является ключевым понятием для расчетов в химии. Она позволяет переводить массу вещества из граммов в моли и наоборот. Например, зная массу вещества в граммах и его молярную массу, можно определить число молей данного вещества.
Молярную массу можно найти, используя периодическую систему элементов. Атомные массы элементов указаны в таблице, и их следует сложить с учетом количества каждого элемента в молекуле соединения.
Молярный объем – это объем, занимаемый одним молем газа при определенных стандартных условиях (нормальных условиях, которые составляют 0 градусов Цельсия и 1 атмосферное давление).
Мольный объем газа является константой и определяется как 22.4 литра на моль (л/моль) при нормальных условиях.
Зная молярный объем газа, можно определить объем газа, занимаемого данным числом молей газа.
Мольные массы и мольный объем являются важными понятиями для расчетов в химии и используются во множестве различных проблем, связанных с количеством вещества и объемом газов.
Связь моли с количеством вещества
Один моль вещества содержит очень большое количество частиц. Точнее, число частиц в одном моле вещества называется постоянной Авогадро и равно приблизительно 6,022 × 10²³ частиц. Это число называется также числом Авогадро.
Чтобы перейти от массы вещества к количеству вещества в молях, необходимо знать молярную массу данного вещества. Молярная масса – это масса одного моля вещества, выраженная в граммах. Она равна числовому значению атомной массы данного вещества.
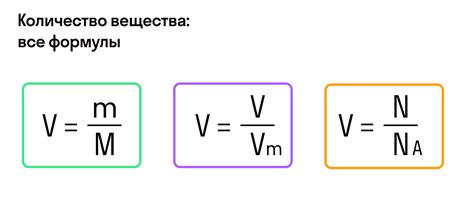
Для расчета количества вещества в молях необходимо разделить массу данного вещества на его молярную массу. Также можно использовать молярный объем, который равен объему одного моля газа при нормальных условиях. Молярный объем газа можно использовать для расчета количества газа в молях.
Практическое применение понятия моль

1. Определение молекулярной массы вещества
Моль позволяет определить молекулярную массу вещества, которая выражается в граммах на моль. Зная количество вещества в молях и его массу, можно определить количество молекул или атомов данного вещества.
2. Расчет химических реакций
Понятие моль позволяет проводить расчеты при химических реакциях. Известное количество реагирующих веществ, выраженное в молях, позволяет определить пропорции реагентов, необходимых для проведения реакции.
3. Разработка новых материалов и лекарств
Моль играет важную роль при разработке новых материалов и лекарств. Зная молекулярную структуру вещества и его мольную массу, можно провести расчеты и определить оптимальные пропорции компонентов, необходимые для создания нового материала или лекарства.
4. Газовые законы
Понятие моль используется в газовых законах, таких как закон газовой диффузии и закон Бойля-Мариотта. Эти законы описывают поведение газов, и моль является основной единицей, используемой для измерения количества газа.
Понятие моль является фундаментальным и необходимым при изучении химии. Оно найдет применение не только в химической науке, но и в различных отраслях промышленности, фармацевтике и многих других областях. Понимание и умение применять понятие моль поможет в изучении химии и позволит лучше понимать процессы, происходящие на молекулярном уровне.



