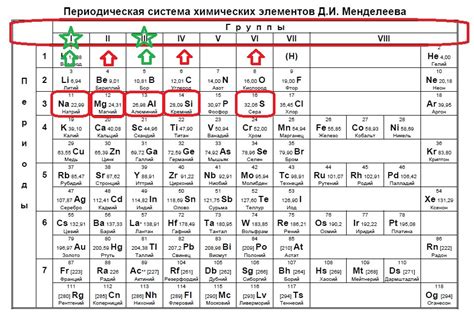
Основное состояние атома – это состояние, в котором атом находится с минимальной энергией. В основном состоянии электроны находятся в наименьших энергетических уровнях и имеют наиболее стабильную конфигурацию. Число электронов в основном состоянии определяется атомным номером элемента и может быть легко вычислено с помощью таблицы Менделеева.
Каждый элемент в периодической таблице имеет свой атомный номер, который определяется количеством протонов в ядре атома. Чтобы вычислить число электронов в основном состоянии элемента, достаточно взять его атомный номер. Например, углерод имеет атомный номер 6, поэтому число электронов в его основном состоянии равно 6.
В основном состоянии электроны в атоме располагаются по энергетическим уровням. На первом энергетическом уровне может находиться не более 2 электронов, на втором – не более 8, на третьем – не более 18 и т.д. Число электронов в основном состоянии будет наибольшим на самом последнем энергетическом уровне, который заполнен полностью или частично.
Что такое число электронов в основном состоянии?

Число электронов в основном состоянии определяется расположением атомных оболочек и подобного количества электронов в них. Каждая оболочка имеет свою энергетическую структуру и может содержать определенное количество электронов. Например, в первой оболочке может находиться максимум 2 электрона, во второй - до 8 электронов и так далее.
Число электронов в основном состоянии можно определить с помощью электронной конфигурации атома или иона. Электронная конфигурация отображает распределение электронов по оболочкам и подуровням энергии. Например, для атома кислорода в основном состоянии электронная конфигурация будет 1s2 2s2 2p4, что означает, что в первой оболочке находится 2 электрона, во второй оболочке - 2 электрона, и в подуровнее p второй оболочки - 4 электрона.
Число электронов в основном состоянии влияет на химические свойства и реакционную способность атомов и ионов. Оно определяет возможность атома или иона участвовать в химических реакциях и образовать определенные соединения. Знание числа электронов в основном состоянии позволяет более глубоко понять строение и свойства атомов и их взаимодействие в химических процессах.
Как определить число электронов в основном состоянии?
Основное состояние атома представляет собой наиболее стабильное и энергетически выгодное состояние атома, при котором все его электроны находятся в наименьших энергетических уровнях. Число электронов в основном состоянии можно определить, зная электронную конфигурацию атома.
Электронная конфигурация атома указывает, в каких энергетических уровнях находятся его электроны и как они распределены вокруг ядра. Определение числа электронов в основном состоянии основывается на правиле заполнения энергетических уровней и подуровней:
- На первом энергетическом уровне может находиться не более 2 электронов.
- На втором энергетическом уровне может находиться не более 8 электронов.
- На третьем энергетическом уровне может находиться не более 18 электронов.
- На четвертом и последующих энергетических уровнях число электронов может быть больше 18.
Для определения числа электронов в основном состоянии нужно распределить электроны по энергетическим уровням в порядке возрастания энергии, соблюдая правила заполнения. Например, для атома кислорода (О) электронная конфигурация будет следующей:
- 1s2
- 2s22p4
Из электронной конфигурации видно, что на первом энергетическом уровне находятся 2 электрона, на втором энергетическом уровне находятся 2+4=6 электронов. Таким образом, число электронов в основном состоянии атома кислорода равно 8.
Зная электронную конфигурацию атома, можно определить число электронов в основном состоянии для любого элемента.
Примеры числа электронов в основном состоянии
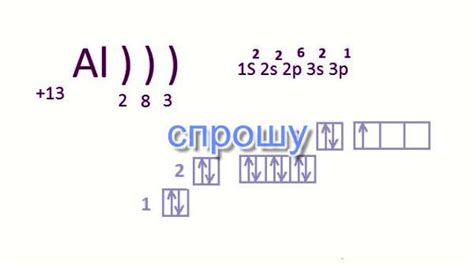
Число электронов в основном состоянии для каждого атома зависит от его атомного номера и периодической таблицы химических элементов. В основном состоянии атом стремится к наиболее стабильному электронному конфигурации, которая обеспечивает минимальную энергию.
Вот несколько примеров числа электронов в основном состоянии для некоторых химических элементов:
| Химический элемент | Атомный номер | Число электронов в основном состоянии |
|---|---|---|
| Водород (H) | 1 | 1 |
| Углерод (C) | 6 | 6 |
| Кислород (O) | 8 | 8 |
| Хлор (Cl) | 17 | 17 |
| Железо (Fe) | 26 | 26 |
| Серебро (Ag) | 47 | 47 |
Это только некоторые примеры, и число электронов в основном состоянии может варьироваться в зависимости от элемента. Чтобы определить количество электронов в основном состоянии для других элементов, можно использовать периодическую таблицу или формулы, основанные на электронной конфигурации атомов.
Что влияет на число электронов в основном состоянии?
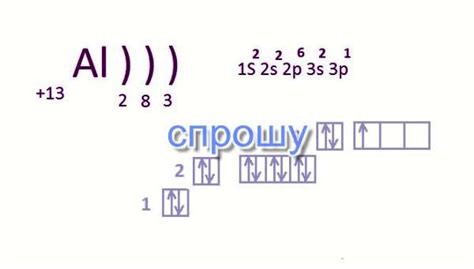
Число электронов в основном состоянии атома определяется его строением и электронной конфигурацией. Оно зависит от двух основных факторов: количества электронных оболочек и заполненности этих оболочек.
Каждая электронная оболочка имеет определенную вместимость, то есть может содержать определенное число электронов. Первая оболочка может вместить максимум 2 электрона, вторая - 8 электронов, третья - 18 электронов, и так далее. Именно эта закономерность обусловлена существованием электронных уровней энергии.
Заполненность электронных оболочек в атоме определяется принципом заполнения электронных уровней, известным как принцип Ауфбау. Согласно этому принципу, электроны заполняют энергетически более низкие уровни перед тем, как перейти на уровни более высокие. Это означает, что электроны заполняют энергетические уровни в атоме по порядку, начиная с самого низкого.
Например, атом кислорода имеет 8 электронов в основном состоянии. Первая оболочка заполняется 2 электронами, вторая оболочка - 6 электронами. Атом углерода, в свою очередь, имеет 6 электронов, которые заполняют первую и вторую оболочки. В атоме гелия наиболее внешняя оболочка заполняется всего 2 электронами.
Таким образом, число электронов в основном состоянии атома определяется внутренним строением атома и принципами заполнения электронных оболочек. Это число играет важную роль в химических реакциях и свойствах атома.
| Атом | Число электронов в основном состоянии |
|---|---|
| Водород (H) | 1 |
| Гелий (He) | 2 |
| Литий (Li) | 3 |
| Бериллий (Be) | 4 |
| Бор (B) | 5 |
Как связано число электронов с энергией?

Каждый электрон в атоме или молекуле занимает свой энергетический уровень, который указывает на его энергию. Более высокие энергетические уровни соответствуют электронам с большей энергией. Таким образом, число электронов в основном состоянии определяет общую энергию системы.
Например, рассмотрим атом кислорода, у которого в основном состоянии находятся 8 электронов. Каждый электрон занимает свой энергетический уровень, нижние уровни заняты 2 электронами, а верхний уровень - 4 электронами. Общая энергия атома кислорода определяется энергиями этих электронов на их соответствующих энергетических уровнях. Если в основном состоянии находится больше электронов, общая энергия будет ниже.
Таким образом, число электронов в основном состоянии играет важную роль в определении энергетического уровня атома или молекулы. Большее число электронов соответствует более низкой общей энергии системы, а меньшее число электронов - более высокой энергии.
Что это значит для химической реактивности?
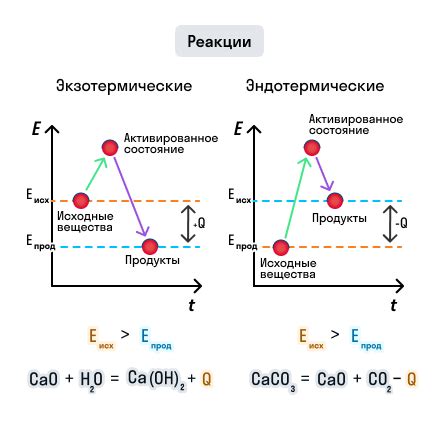
Число электронов в основном состоянии атома играет ключевую роль в определении его химической реактивности. Оно влияет на способность атома образовывать связи с другими атомами и участвовать в химических реакциях.
Когда атом имеет полностью заполненные энергетические уровни и все его электроны находятся в основном состоянии, он обычно является стабильным и мало реактивным. Такие атомы обычно не образуют химических связей с другими атомами, так как они уже достигли электронной конфигурации, при которой энергия системы минимальна.
С другой стороны, если атом имеет неполностью заполненные энергетические уровни в основном состоянии, он имеет потенциал для образования химических связей с другими атомами. Это происходит за счет того, что атом стремится достичь более стабильного состояния, заполнив свои энергетические уровни. Атомы с непарными электронами в своем внешнем энергетическом уровне (валентной оболочке) часто обладают большей химической реактивностью и склонностью к образованию связей с другими атомами.
Например, атом кислорода в основном состоянии имеет 6 электронов в валентной оболочке, что означает, что он имеет возможность образовывать две связи с другими атомами для заполнения своей оболочки и достижения более стабильной конфигурации. Кислородная молекула (O2) состоит из двух атомов кислорода, каждый из которых образует двойную связь с другим атомом кислорода. Эта связь обусловлена стремлением атомов кислорода заполнить свои валентные оболочки и достичь стабильного состояния.
Таким образом, число электронов в основном состоянии определяет, насколько химически реактивным будет атом и его способность образовывать связи с другими атомами. Это концептуальное понимание имеет важное значение в химии и помогает объяснить множество химических процессов и реакций.
Как взаимодействуют электроны в основном состоянии?
Электроны в основном состоянии атома могут взаимодействовать между собой и с ядром. Это взаимодействие определяется законами квантовой механики и электромагнетизма.
Основное состояние атома характеризуется тем, что электроны находятся в наименьших энергетических уровнях, ближе всего к ядру. Каждый электрон обладает определенным набором квантовых чисел, которые описывают его энергию и момент.
Электроны в основном состоянии могут взаимодействовать друг с другом, образуя электронные пары или электронные облака. Это важно с точки зрения структуры атома и его свойств. Взаимодействие электронов в основном состоянии определяет возможность образования химических связей и стабильность атома в целом.
Кроме того, электроны в основном состоянии взаимодействуют с ядром атома. Это взаимодействие определяет энергетический уровень электрона и его положение в атоме. В результате взаимодействия электронов с ядром образуются орбитали - области пространства, где электрон может находиться с наибольшей вероятностью.
Понимание взаимодействия электронов в основном состоянии атома является ключевым для объяснения многих явлений в химии и физике. Оно позволяет предсказывать свойства атомов, их способность к химическим реакциям и образованию химических соединений. Это основа для разработки новых материалов и технологий, а также для понимания многих процессов в живых организмах.
Практическое применение числа электронов в основном состоянии
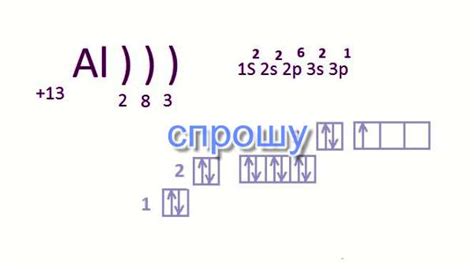
В химии число электронов в основном состоянии атома определяет его химические свойства и возможность образования химических связей. Например, атомы с полностью заполненными электронными оболочками (например, гелий) обычно не образуют химических связей, в то время как атомы, имеющие неполностью заполненные оболочки, активно участвуют в химических реакциях.
В физике число электронов в основном состоянии атома влияет на его электронные уровни энергии. Это связано с электронными переходами и спектральными характеристиками вещества. Например, электронно-магнитные свойства материалов зависят от количества и распределения электронов в атомах.
В материаловедении и электронике понимание числа электронов в основном состоянии атома помогает в разработке новых материалов с определенными свойствами. Например, при создании полупроводниковых материалов для производства современных электронных устройств важно иметь контроль над количеством электронов в основном состоянии.
Таким образом, знание числа электронов в основном состоянии атома является необходимым для понимания и применения в различных областях, включая химию, физику, материаловедение и электронику. Оно позволяет уточнить химические свойства веществ, исследовать их электронные уровни энергии и применять полученные знания для разработки новых материалов и устройств.



