Гидролиз сильных электролитов – это процесс, в результате которого электролит разлагается на ионы водой. Конечный продукт гидролиза зависит от состава электролита и pH среды. В данной статье мы ответим на вопросы, связанные с конечным продуктом гидролиза сильных электролитов.
1. Что происходит при гидролизе сильных электролитов?
При гидролизе сильных электролитов происходит разложение ионов водой на катионы и анионы. Количество гидрооксидных и гидроксоноионов, образующихся в результате гидролиза, зависит от степени гидратации ионов и их химической природы.
2. Какой конечный продукт гидролиза сильного кислотного электролита?
При гидролизе сильного кислотного электролита конечным продуктом являются гидроксоноионы. Они образуются в результате реакции ионов кислоты с водой. Гидратационная оболочка оксонионов обеспечивает их стабилизацию в растворе.
3. Какой конечный продукт гидролиза сильного основного электролита?
При гидролизе сильного основного электролита конечными продуктами являются гидрооксидные ионы. Они формируются в результате реакции ионов основания с водой. Гидратационная оболочка оксидионов способствует их стабилизации в растворе.
Таким образом, конечный продукт гидролиза сильного электролита определяется его химическим составом и pH среды. Знание конечного продукта гидролиза сильных электролитов позволяет правильно оценить свойства и реакционную способность этих соединений, что имеет важное значение в различных областях химии и науки о материалах.
Что такое конечный продукт гидролиза?

В результате гидролиза сильных электролитов происходит распад молекулы на положительные и отрицательные ионы, которые вступают в реакцию с водой. В зависимости от природы соли и условий реакции, могут образоваться различные конечные продукты.
Конечный продукт гидролиза может быть кислотой, щелочью или нейтральным веществом. Если результатом гидролиза является образование кислоты, раствор становится кислотным и у него повышается концентрация положительных анионов. Если же образуется щелочь, то раствор становится щелочным и повышается концентрация отрицательных катионов. Если же конечный продукт нейтрален, раствор не меняет своей кислотности или щелочности.
Конечный продукт гидролиза и его свойства имеют важное значение при изучении химических процессов и применении в различных отраслях науки и техники.
Чем отличается конечный продукт гидролиза от обычного гидролиза?
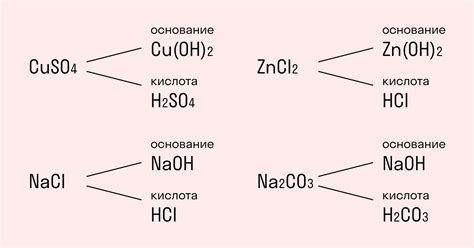
При обычном гидролизе сильных электролитов вода расщепляется на ионы водорода (H+) и гидроксидные ионы (OH-). Этот процесс происходит в растворе сильных кислот и щелочей. В результате обычного гидролиза образуются ионы водорода, которые могут взаимодействовать с другими реагентами в растворе и изменять pH раствора.
В случае конечного продукта гидролиза сильных электролитов, вода расщепляется не только на ионы водорода и гидроксидные ионы, но и на другие ионы, образующиеся вследствие взаимодействия электролитов с водой. Таким образом, конечный продукт гидролиза может содержать ионы кислоты, ионы щелочи и другие ионы, образовавшиеся в результате этого процесса.
Конечный продукт гидролиза может быть нейтральным раствором, если ионы кислоты и ионы щелочи образуют соли, которые имеют противоположные заряды и компенсируют друг друга. Однако он также может быть кислым или щелочным, если ионы соединяются в таком соотношении, что одни преобладают над другими.
Важно отметить, что конечный продукт гидролиза зависит от реагентов, их концентрации и условий реакции.
Изучение конечного продукта гидролиза сильных электролитов позволяет понять его химические свойства и реакционную способность, что имеет важное значение в различных областях науки и технологии.
Как происходит гидролиз сильных электролитов?
Гидролиз сильного электролита происходит в водном растворе, когда молекулы электролита разлагаются на ионы под влиянием воды. Гидролиз может быть двусторонним и односторонним, в зависимости от степени химической активности ионов.
При гидролизе катиона водородную ионизирующую способность иона (кислотность) можно определить по его сопряженной кислоте. Если ион катиона является сильной кислотой, то гидролиз будет происходить в щелочной среде. Если же ион катиона является слабой кислотой, то гидролиз будет происходить в кислой среде.
Гидролиз аниона водородную ионизирующую способность иона (основность) можно определить по его сопряженной основе. Если ион аниона является сильной основой, то гидролиз будет происходить в кислой среде. Если же ион аниона является слабой основой, то гидролиз будет происходить в щелочной среде.
В результате гидролиза сильных электролитов образуются новые вещества: водородные ионы и ионы сопряженной кислоты или основы. Изменение pH раствора, вызванное гидролизом, зависит от концентрации гидролизующегося электролита и его константы гидролиза.
Какие типы сильных электролитов существуют?

Сильные кислоты образуются при растворении в воде ионизируются полностью, образуя большое количество водородных (H+) ионов. Некоторые из известных сильных кислот включают серную кислоту (H2SO4), хлороводородную кислоту (HCl) и азотную кислоту (HNO3).
Сильные основания, с другой стороны, ионизируются полностью, образуя большое количество гидроксидных (OH-) ионов. Некоторые из известных сильных оснований включают гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид бария (Ba(OH)2).
Кроме того, существуют также некоторые соли, которые могут быть сильными электролитами. Эти соли, такие как хлорид натрия (NaCl) и нитрат калия (KNO3), полностью распадаются на ионы при растворении в воде.
- Примеры сильных кислот:
- Серная кислота (H2SO4)
- Хлороводородная кислота (HCl)
- Азотная кислота (HNO3)
- Примеры сильных оснований:
- Гидроксид натрия (NaOH)
- Гидроксид калия (KOH)
- Гидроксид бария (Ba(OH)2)
- Примеры солей:
- Хлорид натрия (NaCl)
- Нитрат калия (KNO3)
Какова роль конечного продукта гидролиза в химических процессах?

Роль конечного продукта гидролиза в химических процессах может быть разнообразной. Он может являться итоговым продуктом реакции, а также участвовать в последующих реакциях и превращениях.
Конечные продукты гидролиза могут быть использованы в различных отраслях химии и промышленности. Например, они могут служить сырьем для производства других химических соединений. Кроме того, конечные продукты гидролиза могут быть важными компонентами пищевых продуктов, фармацевтических препаратов или косметических средств.
Конечные продукты гидролиза могут также играть важную роль в биохимических процессах, происходящих в живых организмах. Они могут быть использованы как источник энергии или строительных блоков для клеточных процессов, а также участвовать в обмене веществ и регуляции функций организма.
Таким образом, конечные продукты гидролиза имеют значительное значение в химических процессах, обеспечивая возможность получения новых соединений, влияя на качество и свойства продуктов, а также участвуя в биохимических процессах живых организмов.
Каким образом конечный продукт гидролиза влияет на pH раствора?

Гидролиз представляет собой реакцию, при которой сильный электролит (как, например, кислота или основание) разлагается на ионы в водном растворе. Конечные продукты гидролиза могут влиять на pH раствора.
Если конечный продукт гидролиза – кислота, то раствор становится кислотным. Это происходит из-за того, что гидролиз кислоты происходит с образованием протонов (H+ ионов). Такие ионы обладают кислотными свойствами и снижают pH раствора.
Если конечный продукт гидролиза – основание, то раствор становится щелочным. В процессе гидролиза основания происходит образование гидроксид-ионов (OH-) или других основных ионов, которые повышают концентрацию OH-ионов в растворе. Это приводит к повышению pH раствора и его щелочности.
Изменение pH раствора в результате гидролиза сильного электролита может иметь важные последствия для многих химических и биологических процессов. Поэтому понимание влияния конечных продуктов гидролиза на pH является важным аспектом в химии и науке о растворах.
Как определить конечный продукт гидролиза вещества?

- Изучение реакций гидролиза. Различные вещества могут подвергаться гидролизу с образованием разных продуктов. Исследование реакций гидролиза помогает определить конечные продукты.
- Использование физических и химических свойств. Конечные продукты гидролиза могут иметь отличные физические и химические свойства, которые могут быть использованы для их идентификации.
- Анализ ионного состава. Анализ ионного состава образцов после гидролиза позволяет определить наличие и количество различных ионов, что помогает определить конечные продукты.
- Использование специальных методов анализа. Существуют специальные методы анализа, такие как спектральный анализ или хроматография, которые могут быть использованы для определения конечных продуктов гидролиза сильных электролитов.
Определение конечных продуктов гидролиза вещества является важным шагом при изучении и анализе химических реакций. Это позволяет понять и предсказать результаты реакций в различных условиях и имеет практическое применение в разных сферах науки и технологии.
Какие методы анализа можно использовать?
Для изучения и анализа конечного продукта гидролиза сильных электролитов существует несколько методов:
- Титриметрический метод анализа. Этот метод основан на определении концентрации ионов вещества с помощью титрования раствора этого вещества раствором известной концентрации другого вещества.
- Гравиметрический метод анализа. Данный метод основан на определении массы вещества в растворе путем его осаждения и последующего взвешивания.
- Спектрофотометрический метод анализа. Этот метод основан на измерении поглощения или пропускания света через раствор вещества с использованием специального прибора - спектрофотометра.
- Электрохимический метод анализа. В этом методе используется изменение электрических свойств раствора вещества под воздействием внешнего электрического поля.
Каждый из этих методов имеет свои преимущества и ограничения, поэтому выбор метода анализа зависит от поставленных задач и требуемой точности результатов.
Какие свойства имеет конечный продукт гидролиза?

Конечный продукт гидролиза сильных электролитов обычно представляет собой раствор ионов водорода (H+) и гидроксид-ионов (OH-). Эти ионы могут проявлять различные свойства, которые обуславливаются их химической активностью.
Основные свойства конечного продукта гидролиза включают:
| Свойство | Описание |
|---|---|
| Кислотность или щелочность | Конечный продукт гидролиза может быть кислым, щелочным или нейтральным в зависимости от вида электролита и его степени гидролиза. Кислые растворы содержат большее количество H+ и более низкий pH, а щелочные - большее количество OH- и более высокий pH. |
| Электропроводность | Конечный продукт гидролиза, содержащий ионы H+ или OH-, обладает высокой электропроводностью, поскольку эти ионы могут перемещаться по раствору, обеспечивая проводимость электрического тока. |
| Реактивность | Ионы H+ и OH- могут участвовать в реакциях образования водорода и гидроксида соответственно. Эта реактивность делает конечный продукт гидролиза важным в химических превращениях и реакциях. |
Итак, конечный продукт гидролиза сильных электролитов обладает определенными свойствами, которые определяют его химическую активность и его значение в различных химических процессах.
Какова его растворимость и внешний вид?
После гидролиза сильных электролитов, конечный продукт обычно обладает высокой степенью растворимости в воде. Это связано с тем, что в процессе гидролиза ионные соединения расщепляются на ионы, которые могут легко раствориться в воде.
Внешний вид конечного продукта зависит от его химического состава. Некоторые продукты гидролиза могут быть кристаллическими соединениями, иметь форму раствора или желатинообразную консистенцию. Цвет может варьироваться от прозрачного до различных оттенков в зависимости от наличия окрашивающих веществ.
Какие могут быть применения конечного продукта гидролиза?
Процесс гидролиза сильных электролитов может привести к образованию различных конечных продуктов, которые имеют важные применения в различных областях.
Конечный продукт гидролиза может быть использован в производстве удобрений. Например, гидролиз карбидов, нитридов и фосфидов может привести к образованию аммиака и азотной и карбоновой кислот, которые широко применяются в сельском хозяйстве.
Еще одним важным применением конечного продукта гидролиза является его использование в химической промышленности. Например, обработка сильных электролитов может привести к образованию различных органических кислот, которые являются важными сырьем для производства пластмасс, лекарственных препаратов и других химических соединений.
Также конечный продукт гидролиза может быть использован в водоочистке. Например, обработка сильных электролитов может привести к образованию неорганических кислот, которые могут использоваться для нейтрализации загрязнений в воде.
Одним из интересных применений конечного продукта гидролиза является его использование в производстве энергии. Например, гидролиз сильных электролитов может привести к образованию водорода, который может быть использован в качестве источника энергии, как водородное питание или для производства электричества в топливных элементах.
Таким образом, конечный продукт гидролиза сильных электролитов имеет разнообразные применения в сельском хозяйстве, химической промышленности, водоочистке и производстве энергии, что делает этот процесс важным и перспективным в различных отраслях.



