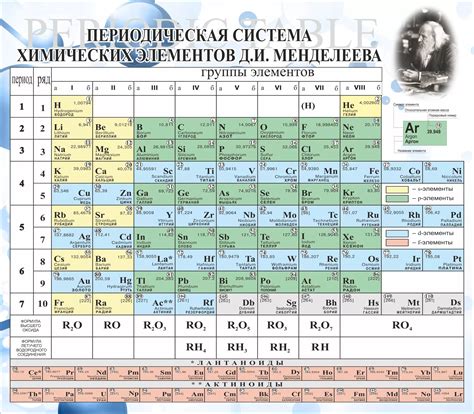
Периодическая система химических элементов, разработанная Дмитрием Ивановичем Менделеевым, является фундаментальным инструментом для понимания химии. В таблице Менделеева представлены все известные элементы, расположенные по возрастанию атомных номеров. Каждый элемент обладает уникальными свойствами, которые определяют его место в таблице.
Основными элементами таблицы Менделеева являются вещества, из которых состоят все живые организмы и окружающий нас мир. Эти элементы включают в себя кислород, углерод, водород, азот, фосфор и другие. Они встречаются в различных соединениях и играют важнейшую роль в биологических процессах.
Таблица Менделеева разделена на группы и периоды. Группы представляют собой вертикальные столбцы, в которых элементы имеют схожие химические свойства. Например, все элементы группы 1, включая литий, натрий и калий, обладают похожими свойствами, такими как высокая реактивность и хорошая проводимость электричества. Периоды, с другой стороны, представляют собой горизонтальные ряды элементов, обладающих похожим количеством электронных оболочек.
Основные элементы таблицы Менделеева
Основными элементами таблицы Менделеева являются химические элементы, которые обладают наиболее широким применением в различных областях науки и техники. Они играют ключевую роль в химических реакциях, образуют соединения и вещества, которые являются основой всего материального мира.
Среди основных элементов таблицы Менделеева можно выделить такие часто встречающиеся в повседневной жизни элементы, как кислород (O), углерод (C), азот (N), водород (H), железо (Fe), медь (Cu), свинец (Pb) и многие другие.
Кислород (O) - один из наиболее распространенных элементов в земной коре и атмосфере. Он играет важную роль в дыхании организмов, окислительных реакциях и других процессах.
Углерод (C) - основной строительный элемент органических соединений, образующих жизнь на Земле. Он является основным компонентом углеводов, жиров, белков и других биологически важных веществ.
Азот (N) - входит в состав многих органических соединений и является важным элементом для роста и развития растений, а также для образования белка и нуклеиновых кислот.
Водород (H) - самый легкий элемент, образующий 90% массы Вселенной. Он является основным элементом воды и многих органических соединений.
Железо (Fe) - один из самых распространенных элементов в земной коре. Он используется в металлургии, строительстве, машиностроении и других отраслях промышленности.
Медь (Cu) - хороший электропроводник и теплопроводник. Она широко используется в электротехнике, строительстве и других отраслях промышленности.
Свинец (Pb) - является тяжелым металлом, который используется в производстве аккумуляторов, покрытий и в косметической промышленности.
Эти и многие другие основные элементы таблицы Менделеева имеют важное значение для нашего мира. Знание и понимание их свойств и химических реакций помогает в различных областях науки и техники, а также повседневной жизни.
Понятие и назначение
Назначение таблицы Менделеева – это обеспечение понимания и систематизации знаний о количестве и разнообразии химических элементов. Благодаря этой таблице химики и другие ученые могут легко найти информацию о химических свойствах, атомных массах, электронной конфигурации и других характеристиках элементов. Также таблица Менделеева помогает прогнозировать свойства еще не открытых элементов и понимать закономерности взаимодействия элементов в химических реакциях.
Систематизация элементов в таблице помогает ученым и студентам легче изучать и понимать свойства и закономерности в химии. Таблица Менделеева также облегчает поиск информации и является ключевым инструментом в образовании и исследовательской работе в области химии и материаловедения.
Структура и основная информация

В таблице Менделеева элементы располагаются горизонтально, начиная с легких элементов в верхнем левом углу и заканчивая тяжелыми элементами в нижнем правом углу. Каждый элемент представлен своим символом, атомным номером и атомной массой. Символ элемента обычно состоит из одной или двух букв, используемых для обозначения его латинского или английского названия.
Таблица Менделеева разделена на группы и периоды. Группы - это вертикальные столбцы элементов, которые имеют сходные химические свойства. Обычно элементы в одной группе имеют одинаковое количество электронов во внешнем энергетическом уровне и похожую химию.
Периоды - это горизонтальные ряды элементов, которые имеют похожее строение электронных оболочек. Периоды помогают определить количество энергетических уровней у элемента. Каждый новый период начинается с элемента, у которого заканчивается заполнение предыдущего периода.
Таблица Менделеева является важным инструментом для изучения и понимания основных химических свойств элементов. Знание основной структуры и информации, представленной в таблице Менделеева, помогает ученым и студентам лучше понять химические процессы и принципы связи между элементами.
Группы в таблице Менделеева
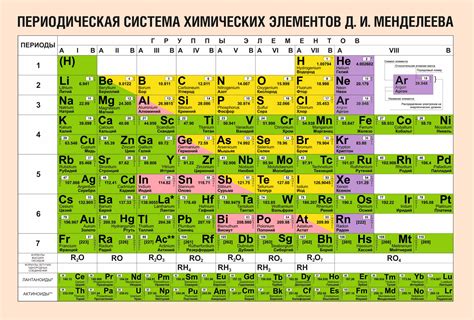
В таблице Менделеева группы сгруппированы по общим свойствам элементов, таким как количество валентных электронов и химические связи. Например, группа 1 – это щелочные металлы, группа 2 – щелочноземельные металлы, группа 17 – галогены.
Каждая группа имеет собственное обозначение, которое помогает идентифицировать элементы в таблице. Обозначение группы указывается над элементами группы. Например, группа 18 обозначается как "0", группа 17 – "7", группа 1 – "1".
Группы в таблице Менделеева помогают классифицировать элементы, делая их более предсказуемыми и упорядоченными. Понимание групп позволяет исследователям и химикам лучше понять взаимодействия и химические реакции элементов в группе и между разными группами.
Группы с позицией s

В таблице Менделеева элементы разделены на различные группы в соответствии с их химическими свойствами. Группы с позицией s состоят из элементов, у которых внешний электрон находится в s-орбитали.
Самая первая группа с позицией s - это группа 1. Ее элементы - водород и щелочные металлы, такие как литий, натрий, калий и др. Эти элементы хорошо растворяются в воде и образуют щелочные растворы, что является одной из основных характеристик этой группы.
Вторая группа с позицией s - это группа 2. Она включает элементы, такие как бериллий, магний, кальций и др. Эти элементы также образуют растворы, но они уже не являются щелочными и реагируют с водой медленнее, чем элементы первой группы.
Группы с позицией s имеют свои химические особенности и обладают сходными свойствами. Они часто используются в различных сферах науки и промышленности, таких как медицина, энергетика, металлургия и др.
Группы с позицией p

Группа 13 (p1) включает элементы бор, алюминий, галлий, индий и таллий. Эти элементы обладают ковкими и поверхностно-активными свойствами, используются в различных отраслях промышленности.
Группа 14 (p2) включает элементы углерод, кремний, германий, олово и свинец. Эти элементы формируют основу органических и неорганических соединений. Кремний и углерод имеют огромное значение в технологии, микроэлектронике и биохимии.
Группа 15 (p3) включает элементы азот, фосфор, мышьяк, антимон и бисмут. Азот является одним из критических элементов для жизни, а фосфор используется в производстве удобрений и составе биологически активных соединений.
Группа 16 (p4) включает элементы кислород, сера, селен, теллур и полоний. Кислород является одним из основных элементов для поддержания жизни на Земле, а сера используется в промышленности при производстве удобрений и химических соединений.
Группа 17 (p5) включает элементы фтор, хлор, бром, йод и астат. Эти элементы обладают высокой реактивностью и используются в производстве различных химических соединений.
Группа 18 (p6) включает инертные газы или благородные газы: гелий, неон, аргон, криптон, ксенон и радон.
Группы с позицией d

Группы с позицией d объединяют в себе несколько подгрупп элементов, включая актуальные d-блоки (расположенные между s- и p-блоками) и фальшивые блоки (расположенные после p-блоков).
Актуальные d-блоки включают следующие группы:
| 3 | 4 | |||||
| 11 | 12 | 4 | ||||
| 57-71 | 89-103 |
Фальшивые блоки включают следующие группы:
| 21 | 30 | |||||
| 39 | 40 | 41 | 42 | 57-71 | 89-103 | 104 |
Элементы в группах с позицией d обладают подобными химическими свойствами и имеют сходные электронные конфигурации. Изучение данных групп является важной частью химического образования и понимания периодической системы элементов.



