Химия восьмого класса является одним из самых интересных разделов естественных наук. Восьмиклассники начинают глубже погружаться в мир химических элементов, соединений и реакций. Они учатся определять и описывать свойства веществ, различать химические процессы и узнают о том, как химия применяется в повседневной жизни и различных отраслях науки и промышленности. При изучении химии восьмого класса особое внимание уделяется систематизации и расширению предыдущих знаний о химических элементах и химических процессах.
Восьмиклассники углубляются в понимание строения атомов и их взаимодействия. Они изучают таблицу Менделеева и учатся определять химические элементы по атомному номеру и химическим свойствам. Различные группы элементов, такие как щелочные металлы, щелочноземельные металлы, галогены и инертные газы становятся хорошо знакомыми для восьмиклассников. Они узнают о значении элементов в природных и искусственных соединениях, а также их влиянии на физические и химические свойства веществ.
Другим важным аспектом изучения химии восьмого класса являются химические реакции и их уравнения. Восьмиклассники учатся записывать химические уравнения, понимать, как вещества взаимодействуют и превращаются в другие вещества, а также какие факторы влияют на скорость химической реакции. Они узнают о различных типах реакций, таких как соединение, разложение, замещение, окисление и восстановление, и учатся распознавать их по химическим формулам и уравнениям.
Структура атома и периодическая система элементов

Атом – это наименьшая частица вещества, единица химической структуры. Он состоит из ядра и электронных оболочек. Ядро атома содержит протоны и нейтроны, а вокруг ядра располагаются электроны. Электроны находятся на определенных энергетических уровнях, называемых электронными оболочками.
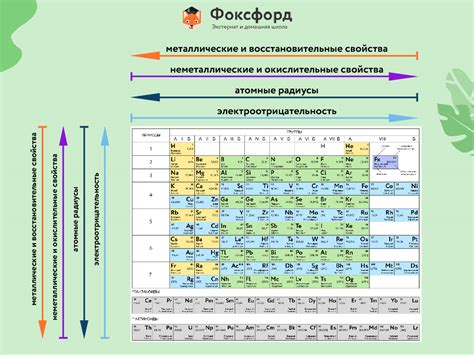
Периодическая система элементов – это таблица, в которой элементы располагаются в порядке возрастания атомного номера. Эта система позволяет систематизировать и классифицировать все известные элементы. В периодической системе элементы разделены на группы и периоды.
Каждый элемент в периодической системе обозначается символом, который состоит из одной или двух букв. Например, кислород обозначается символом O, углерод - C, железо - Fe.
Периоды в периодической системе – это строки, которые располагаются горизонтально. Каждый период представляет собой энергетическую оболочку атомов элементов.
Группы в периодической системе - это столбцы, которые располагаются вертикально. В одной группе элементы имеют схожие свойства, такие как электроны на последней энергетической оболочке. Главная группа - это группы, обозначенные цифрами от 1 до 2 и от 13 до 18. Побочные группы - это группы, обозначенные цифрами от 3 до 12.
Изучение структуры атома и периодической системы элементов позволяет понять, какие свойства имеет каждый элемент и как они связаны с его строением. Эта тема является важным основанием для дальнейшего изучения химии.
Химические элементы и их свойства
Список химических элементов, которые обычно изучаются восьмиклассниками:
- Водород (H) - самый легкий химический элемент, горючий и взрывоопасный газ;
- Кислород (O) - безцветный газ, необходимый для существования большинства живых организмов;
- Углерод (C) - основной строительный элемент органических соединений, является основой для жизни;
- Азот (N) - газ, входящий в состав белка и ДНК;
- Железо (Fe) - металл, используемый для производства стали и других материалов;
- Медь (Cu) - металл, используемый для проводов и производства монет;
- Сера (S) - элемент с ярко-желтым цветом, используется в производстве удобрений и взрывчатки;
- Алюминий (Al) - легкий металл, широко используемый в промышленности;
Каждый химический элемент имеет свои уникальные свойства:
- Атомный номер - это количество протонов в ядре атома, определяющее его химические свойства;
- Атомная масса - средняя масса атомов элемента, учитывая все его стабильные изотопы;
- Физические свойства - плотность, температура кипения и плавления, твердость и т.д.;
- Химические свойства - реактивность, способность образовывать соединения и т.д.;
- Исторические и промышленные аспекты - история открытия, основные способы получения и использования.
Изучение химических элементов и их свойств позволяет ученикам понять основы химии и важность элементов в нашей жизни.
Химические связи и молекулярные соединения
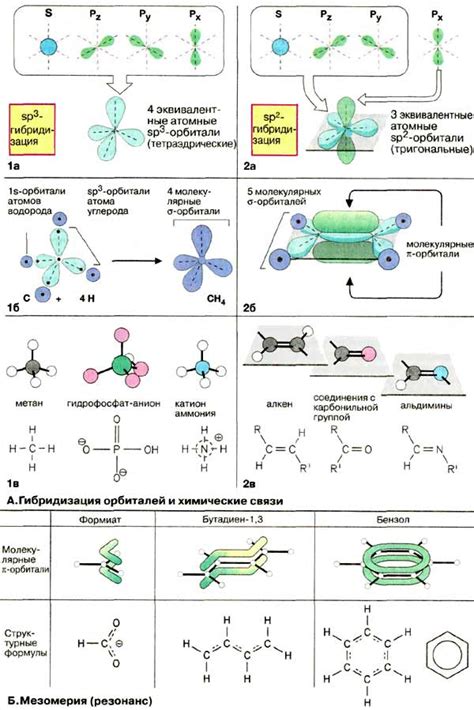
Существует несколько видов химических связей: ионная, ковалентная и металлическая. Ионная связь образуется между атомами с разными зарядами, при этом один атом отдает электроны, а другой получает их. Ковалентная связь образуется путем совместного использования электронных пар. Металлическая связь характерна для металлов и основана на свободном передвижении электронов.
Молекулярное соединение - это химическое соединение, состоящее из двух или более атомов, объединенных химическими связями. Молекулы могут состоять из атомов одного или разных элементов. В случае, когда молекула состоит из атомов одного элемента, она называется простой. Если в молекуле присутствуют атомы разных элементов, то она является сложной.
Молекулярные соединения имеют определенные формулы, которые отображают количество и тип атомов в молекуле. Формулы могут быть простыми, например H2O (вода), или сложными, например C6H12O6 (глюкоза).
В химии восьмого класса учащиеся изучают разные свойства химических соединений, учатся записывать их формулы, проводить расчеты по количеству вещества и массе, а также изучают принципы реакций и перевода вещества из одной формы в другую.
| Виды химических связей | Примеры соединений |
|---|---|
| Ионная связь | NaCl (хлорид натрия), MgO (оксид магния) |
| Ковалентная связь | H2O (вода), CO2 (углекислый газ) |
| Металлическая связь | Cu (медь), Fe (железо) |
Окислительно-восстановительные реакции
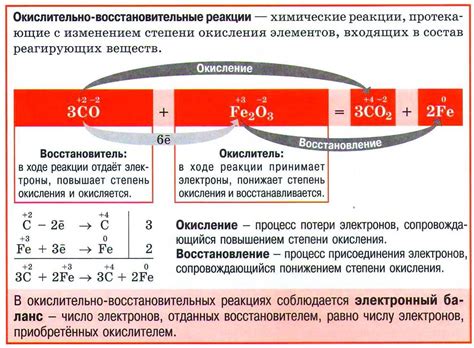
В химии восьмого класса рассматривается основное понятие окислительно-восстановительных реакций, а именно реакции окисления и восстановления. Окисление - это процесс, при котором вещество теряет электроны и повышает свою степень окисления. Восстановление - это процесс, при котором вещество получает электроны и понижает свою степень окисления.
Окислительно-восстановительные реакции могут протекать как в растворах, так и на поверхности твердого вещества. Важными примерами окислительно-восстановительных реакций являются горение и реакции резницой.
В химии восьмого класса изучаются основные принципы окислительно-восстановительных реакций: правило простой подстановки, правило изменения степени окисления, определение степени окисления вещества.
Формулы и уравнения химических реакций
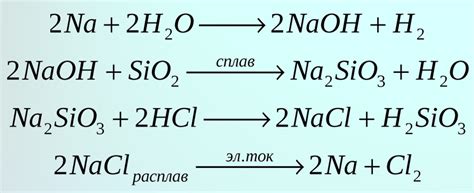
Химические уравнения, в свою очередь, описывают протекание химических реакций. Они позволяют узнать, какие вещества участвуют в реакции, какие вещества образуются и в каких соотношениях.
Химические уравнения имеют следующую структуру:
Реагенты → Продукты
Левая часть уравнения содержит вещества, участвующие в реакции и называется реагентами. Правая часть содержит вещества, которые образуются в результате реакции и называется продуктами.
Формулы и уравнения химических реакций являются основой для понимания принципов химии и позволяют рассчитывать количество веществ, участвующих в реакции. Они также помогают предсказывать изменения, происходящие веществах при смешивании и взаимодействии друг с другом.
Освоение формул и уравнений химических реакций поможет школьникам глубже понять законы природы и расширить свои знания в области химии.
Растворы и их свойства

Концентрация растворов определяется количеством растворенного вещества в единице объема растворителя. Она может быть выражена в процентах, молях или граммах на литр. Восьмиклассники учатся считать концентрацию различных типов растворов и понимают ее значения при проведении химических экспериментов.
Температурные изменения - одно из важных свойств растворов. При растворении некоторых веществ, сопровождающемся поглощением или выделением тепла, происходят эндотермические или экзотермические реакции. Школьники изучают законы термодинамики и применяют их для объяснения температурных изменений в различных растворах.
Прозрачность - это свойство растворов пропускать или блокировать свет. Восьмиклассники изучают, как различные вещества влияют на прозрачность растворов. Они также изучают оптические свойства растворов, такие как показатель преломления и дисперсия.
Проводимость растворов - это способность растворов проводить электрический ток. Школьники учатся измерять проводимость различных растворов и объяснять ее в зависимости от наличия электролитов или неполярных молекул.
| Свойство растворов | Описание |
|---|---|
| Концентрация | Количество растворенного вещества в единице объема растворителя |
| Температурные изменения | Изменение температуры при растворении вещества |
| Прозрачность | Способность раствора пропускать или блокировать свет |
| Проводимость | Способность раствора проводить электрический ток |
Химический анализ

В процессе изучения химического анализа восьмиклассники узнают о различных методах определения веществ, таких как объемный, гравиметрический и титриметрический анализ.
В объемном анализе изучается зависимость между объемом раствора и количеством вещества в нем. Восьмиклассникам объясняется, что в объемном анализе используют различные инструменты, например мерный цилиндр или бюретку.
Гравиметрический анализ основан на измерении массы вещества. Восьмиклассники узнают о различных методах гравиметрического анализа, таких как оттяжка или осаждение вещества на фильтр, а также обработка полученных результатов.
Титриметрический анализ – это метод определения концентрации вещества в растворе путем титрования. Восьмиклассники изучают, как проводить титрование, и осваивают расчеты, чтобы определить концентрацию исследуемого вещества.
Химический анализ позволяет ученикам изучать и практиковать разные методы определения состава вещества. Эти навыки могут быть полезными не только в учебе, но и в реальной жизни, например, при проведении анализа качества питьевой воды или пищевых продуктов.
Органическая химия
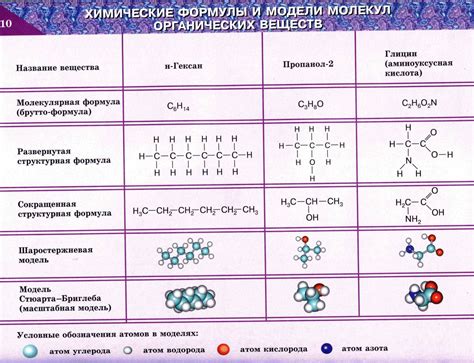
Учащиеся также узнают об основных методах получения органических соединений, таких как синтез, разложение и превращение. Они изучают примеры органических соединений, их свойства и реакции, а также учатся проводить простые эксперименты для подтверждения теоретических знаний.
Восьмиклассники изучают органическую номенклатуру - систему названия органических соединений. Они узнают о правилах называния и классификации соединений и научатся определять их по названию или структуре.
Органическая химия является важной предметной областью, особенно для понимания биологических и медицинских процессов. Восьмиклассники могут применять свои знания органической химии для понимания свойств и реакций веществ, а также для изучения действия лекарств и пищевых добавок.
Применение химии в жизни и промышленности

В повседневной жизни химия используется во многих областях. Например, при готовке пищи, мы используем химические реакции, чтобы превратить сырые продукты во вкусные и полезные блюда. Также мы обращаемся к химии в бытовой химии, используя моющие средства, средства для ухода за телом и другие продукты, которые включают химические вещества.
Химия также является неотъемлемой частью промышленности. Промышленные процессы, такие как производство пластика, топлива, лекарств и многих других продуктов, основаны на химических реакциях и процессах. Применение химии в промышленности позволяет создавать новые материалы и продукты, улучшать их качество и эффективность, а также сохранять окружающую среду и улучшать условия жизни.
Восьмиклассники изучают основные принципы химии, такие как структура веществ, химические реакции, элементы и соединения, растворы и многое другое. Эти знания помогают им лучше понять мир химии и применять их в реальной жизни, а также могут стать основой для дальнейшего изучения химии и выбора профессии в этой области.
Изучение химии дает возможность увидеть, как многое вокруг нас связано с химическими процессами и понять их значение для нашей жизни и промышленности.