Cl2o - это формула химического соединения, известного как двухокись хлора. Этот соединительный элемент, состоящий из атомов хлора и кислорода, обладает уникальными свойствами и находит широкое применение в различных областях химии.
Одним из основных свойств Cl2o является его окислительная активность. Это означает, что соединение способно принимать электроны от других веществ, что приводит к окислению последних. Благодаря этой способности, двухокись хлора широко используется в процессе окисления органических и неорганических соединений.
Еще одно важное свойство Cl2o - его способность к гидролизу. Когда двухокись хлора вступает в реакцию с водой, она распадается на хлорид и хлорную кислоту. Этот процесс приводит к образованию кислого вещества, которое находит применение в промышленности для производства кислотных соединений.
Общая информация о Cl2o

Cl2o является мощным окислителем и может реагировать с многими органическими и неорганическими веществами. Оно реагирует с водой, образуя кислородную кислоту (HClO3). Само Cl2o довольно нестабильно и может разлагаться при повышенных температурах или в присутствии света.
Cl2o применяется в химической промышленности для получения различных хлорсодержащих соединений. Также он используется в качестве дезинфицирующего средства в водоочистке и обработке сточных вод.
В заключении, Cl2o - это химическое соединение, которое обладает мощными окислительными свойствами и находит применение в различных областях, включая химическую и водоочистительную промышленность.
Физические свойства Cl2o

Cl2o (дихлориил) представляет собой молекулу с двумя атомами хлора и одним атомом кислорода. Это красновато-желтый газ с резким запахом. Обратите внимание, что Cl2o очень ядовит, поэтому необходима осторожность при работе с ним.
Ниже приведена таблица с основными физическими свойствами Cl2o:
| Физическое свойство | Значение |
|---|---|
| Формула | Cl2o |
| Молярная масса | 86.9 г/моль |
| Плотность | 1.653 г/см³ |
| Температура кипения | -34 °C |
| Температура плавления | -122 °C |
| Растворимость в воде | Реагирует, образуя хлороводородную кислоту и хлористый ион |
Cl2o обладает очень высокой реакционной активностью и используется в различных процессах синтеза органических соединений, а также в производстве хлорпикрина - взрывчатого вещества. Кроме того, Cl2o может использоваться в качестве окислителя в химических реакциях.
Из-за своей ядовитости и высокой реакционной активности, Cl2o требует специальных условий хранения и использования, а также предельной осторожности при работе с ним.
Химические свойства Cl2o
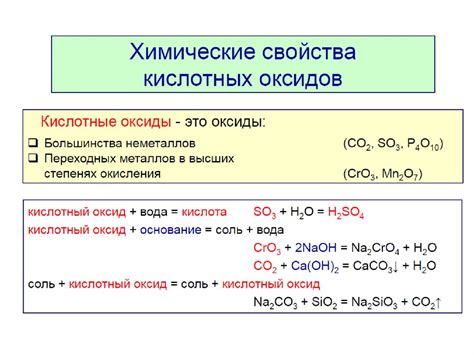
Одно из основных химических свойств Cl2o - его окислительные свойства. Взаимодействуя с другими веществами, хлороксид может передавать свои электроны, что является общей характеристикой окислителей. Это свойство позволяет Cl2o использоваться в различных процессах окисления, включая очистку воды от загрязнений.
Cl2o также обладает отличными дезинфицирующими свойствами. Его способность уничтожать бактерии и вирусы делает его идеальным агентом для использования в медицинских и санитарных целях. Кроме того, хлороксид применяется для обработки воды и различных поверхностей, так как он способен уничтожать патогенные микроорганизмы.
Важным свойством Cl2o является его высокая двухокислотность. Окисление соединений с водородом или металлами может привести к образованию кислородовосстановителей, что делает Cl2o сильным окислителем. Это свойство позволяет хлороксиду использоваться в процессах синтеза органических соединений.
Необходимо отметить, что Cl2o является токсичным и коррозионно активным соединением. Поэтому при работе с ним необходимы меры предосторожности, такие как использование защитных средств и проведение работ в хорошо проветриваемых помещениях.
Реакции Cl2o с другими веществами
| Вещество | Реакция с Cl2o |
|---|---|
| Металлы | Cl2o окисляет металлы, вызывая их термическое разложение с образованием металлического оксида и хлористого соединения. |
| Неорганические кислоты | Cl2o образует сильные оксохлористые кислоты, которые могут быть использованы в дальнейших химических реакциях. |
| Органические соединения | Cl2o может проявлять реакцию с различными органическими соединениями, приводя к окислению, хлорированию или другим превращениям. |
| Вода | Cl2o реагирует с водой, образуя соляную кислоту и кислород. |
| Галогены | Cl2o реагирует с галогенами, образуя соответствующие оксогалогениды. |
Реакции Cl2o с другими веществами могут быть использованы в различных химических процессах, например, в производстве химических соединений или в окислительных реакциях.
Применение Cl2o в промышленности
Один из основных способов использования Cl2o - это производство хлорных соединений. Дикислор активно используется в производстве галогенированных углеводородов, таких как хлорированные растворители и пестициды. Он также применяется при синтезе хлорэтана и хлорэтена, основных компонентов поливинилхлорида (PVC).
Cl2o также широко используется в процессах очистки воды и сточных вод. Он эффективно удаляет органические загрязнители, бактерии и вирусы, а также окрашивающие и запаховые вещества. При этом дикислор не оставляет остатков и не загрязняет окружающую среду.
Другое важное применение Cl2o - в производстве белков, полимеров и красителей. Он используется для окисления аминоацидов и аминов, а также для получения различных окисленных производных. Благодаря своему сильному окислительному действию Cl2o позволяет получать продукты с высокой чистотой и улучшенными свойствами.
Кроме того, Cl2o применяется в процессах производства бумаги и текстиля. Он используется для отбеливания целлюлозы и удаления органических примесей, делая материалы более чистыми и яркими.
Таким образом, Cl2o играет важную роль в промышленности, обладая широким спектром применений от производства химических соединений до очистки и обработки материалов.
Влияние Cl2o на окружающую среду

Во-первых, Cl2o является очень реактивным веществом и может вызывать серьезные ожоги на коже и слизистых оболочках. Это может представлять угрозу для животных и растений, живущих вблизи мест использования Cl2o.
Во-вторых, Cl2o обладает высокой токсичностью и может вызывать серьезные здоровые проблемы у людей и животных, если попадет в организм. При вдыхании Cl2o возможны проблемы с дыхательной системой, а при попадании на кожу или слизистые оболочки возможно раздражение и воспаление.
Кроме того, Cl2o является одним из главных агентов в атмосферной химии, приводящих к разрушению озонового слоя. Его высокая реактивность способствует высвобождению хлора, который вступает в реакцию с молекулами озона и разрушает их. Это может привести к усилению ультрафиолетового облучения на поверхности Земли и увеличению риска развития рака кожи у людей и других живых организмов.
Все вышеперечисленные факторы делают необходимым тщательное контролирование и ограничение использования Cl2o. Важно принимать меры по предотвращению его негативного влияния на окружающую среду, а также заменять его более безопасными альтернативами, когда это возможно.
Меры предосторожности при работе с Cl2o

- Никогда не дышите пары Cl2o непосредственно. Постоянное вдыхание может привести к серьезным проблемам с дыханием и раздражению дыхательных путей.
- Используйте средства индивидуальной защиты, такие как респиратор, защитные очки и резиновые перчатки, при работе с Cl2o. Это поможет избежать прямого контакта с веществом и его попадания на кожу и слизистые.
- Работайте с Cl2o только в хорошо проветриваемых помещениях или под вытяжным шкафом, чтобы избежать скопления паров. Пары Cl2o ядовиты и могут вызывать серьезные отравления.
- Храните Cl2o в герметично закрытой таре, вдали от источников тепла, огня и других реактивных веществ. Cl2o является окислителем и может вызывать пожары в контакте с горючими материалами.
- При работе с Cl2o будьте особенно осторожны, чтобы не попадать в контакт с кожей или глазами. В случае контакта, немедленно промойте область водой в течение нескольких минут и обратитесь к врачу.
- Если Cl2o проливается или разлитая жидкость выпаривается, не пытайтесь очищать ее самостоятельно. Незамедлительно сообщите об этом специалистам и приберитесь под их руководством.
Соблюдение этих мер предосторожности поможет гарантировать безопасную работу с Cl2o и минимизировать риски для здоровья и окружающей среды.



