Гемоглобин - это сложная молекула, которая является основной частью эритроцитов и выполняет важную функцию в нашем организме. Этот белок отвечает за перенос кислорода от легких к тканям, а также за возвращение углекислого газа обратно к легким для его выведения из организма. Структура гемоглобина состоит из четырех подединиц, каждая из которых содержит группу гема.
Четвертичная структура гемоглобина заключает в себе взаимодействие этих четырех подединиц между собой. Эта взаимосвязь имеет ключевое значение для функционирования гемоглобина. В результате совместного действия подединиц образуется специфическая форма молекулы, облегчающая перенос и растворение газов. Важно отметить, что изменение четвертичной структуры гемоглобина может привести к патологическим изменениям и возникновению заболеваний.
Каждая подединица гемоглобина состоит из двух цепей: альфа-и бета-цепи. Распределение этих подединиц зависит от возраста и типа ткани, в которой они находятся. Одна молекула гемоглобина может содержать разные комбинации подединиц. Например, гемоглобин А - это наиболее распространенная форма гемоглобина у взрослых, состоящая из двух альфа-и двух бета-цепей.
Гемоглобин: роль и функции

Один из главных функций гемоглобина - доставка кислорода к тканям организма. Когда гемоглобин связывает кислород в легких, образуется оксигемоглобин, который затем переносится через систему кровообращения к органам и тканям, где он освобождает кислород.
Гемоглобин также играет важную роль в регуляции рН в организме. Он помогает поддерживать стабильный уровень кислотности внутри тела, способствуя нормальной работе метаболических процессов.
Важно отметить, что изменения в структуре или концентрации гемоглобина могут привести к различным заболеваниям, таким как анемия и гемоглобинопатии.
Структура гемоглобина: целиком и частями
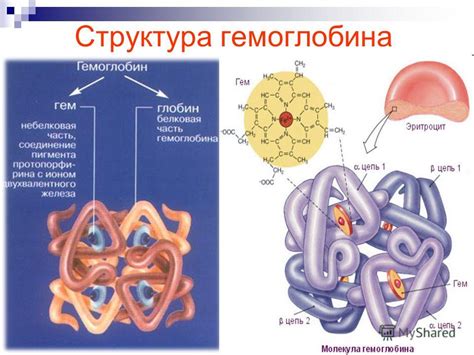
Гем состоит из железа, которое придаёт ему красный цвет, и белковой части - глобина. Глобин состоит из двух альфа-цепей и двух бета-цепей, которые связываются между собой слабыми химическими связями. Именно благодаря такой структуре, гемоглобин способен эффективно связывать кислород и переносить его в организме.
Каждая из подединиц гемоглобина связывает одну молекулу кислорода. Таким образом, вся молекула гемоглобина способна связать до четырех молекул кислорода, что является важным для эффективного транспорта кислорода в организме.
Структура гемоглобина является ключевым фактором, определяющим его способность связывать и передавать кислород. Любое отклонение в структуре гемоглобина может привести к изменению его функциональности и вызвать различные гемоглобинопатии, такие как сфероцитоз, гемолитическая анемия и другие.
Первичная структура гемоглобина: последовательность аминокислот
Первичная структура гемоглобина представляет собой уникальную последовательность аминокислот, закодированную в генах, которая определяет функциональные свойства молекулы гемоглобина. Генетический код в ДНК определяет последовательность аминокислот в каждой полипептидной цепи гемоглобина.
Взаимодействие различных аминокислот в первичной структуре гемоглобина играет важнейшую роль в его функции транспорта и переноса кислорода. Например, наличие специфических аминокислот в цепи гемоглобина позволяет молекуле эффективно связываться с кислородом в легких и транспортировать его к тканям организма.
Изменение последовательности аминокислот в первичной структуре гемоглобина может привести к нарушению его функции и, как следствие, к развитию различных наследственных форм анемии. Такие изменения могут быть вызваны мутациями в генах, которые кодируют гемоглобин, или нарушениями процессов синтеза белка.
Изучение первичной структуры гемоглобина и его последовательности аминокислот позволяет понять механизмы его функционирования и развития нарушений. Это важная задача для медицины, позволяющая разрабатывать методы диагностики и лечения различных форм анемии и других заболеваний, связанных с гемоглобином.
Вторичная структура гемоглобина: спиральная форма

Вторичная структура гемоглобина формируется за счет водородных связей между аминокислотами внутри α-спирали. Эти связи образуют α-геликсы, которые протягиваются вдоль всей α-спирали и придают ей устойчивую пространственную конфигурацию.
Важно отметить, что структура гемоглобина не ограничивается только вторичной структурой. Она также включает в себя пространственную ориентацию и взаимодействие альфа и бета-цепей, а также терциарную и кватерническую структуру молекулы.
Спиральная форма α-спирали гемоглобина обеспечивает оптимальное взаимодействие между аминокислотами и стабильность молекулы в целом. Благодаря этой спиральной структуре гемоглобин способен связывать кислород в легких и доставлять его к клеткам тканей.
Таким образом, вторичная структура гемоглобина в виде спиральной α-спирали играет важную роль в его функциональности и обеспечивает оптимальное связывание и доставку кислорода в организме.
Третичная структура гемоглобина: пространственное строение
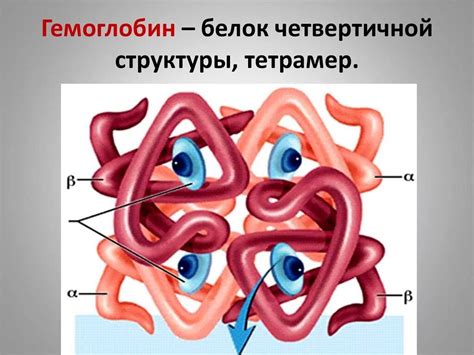
Гемоглобин состоит из двух альфа-цепей и двух бета-цепей, каждая из которых содержит прокариотическую подединицу. Третичная структура гемоглобина формируется благодаря сложной взаимодействиям между аминокислотными остатками внутри молекулы.
Пространственное строение гемоглобина обеспечивает его функциональность. В третичной структуре молекулы гемоглобина образуются несколько свойственных для него структурных элементов, таких как первичные, вторичные и третичные структуры.
Гемоглобин имеет сложное третичное строение благодаря взаимодействиям аминокислотных остатков глобиновой цепи. Основными взаимодействиями являются водородные связи, гидрофобные взаимодействия и ионные связи.
| Структурные элементы третичной структуры гемоглобина: |
|---|
| Альфа-спираль |
| Бета-полотно |
| Водородные связи между различными частями молекулы гемоглобина |
Важно отметить, что третичная структура гемоглобина может быть нарушена различными мутациями, что приводит к развитию гемоглобинопатий или гемоглобиновых болезней.
Четвертичная структура гемоглобина: связывание подъединиц
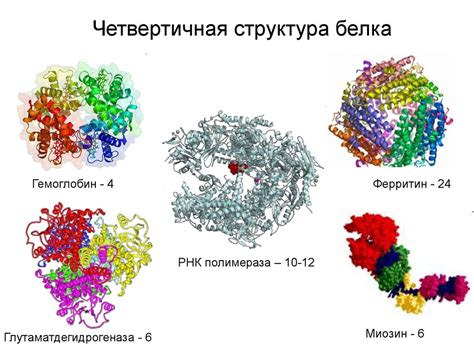
Связывание подъединиц гемоглобина происходит благодаря сложной системе взаимодействий. Главную роль в этом играют гидрофобные и гидрофильные взаимодействия. Каждая подъединица содержит участки, которые образуют гидрофобные и гидрофильные контакты с другими подъединицами.
В результате связывания подъединиц между собой образуется стабильная структура гемоглобина, которая обладает высокой специфичностью и эффективностью в переносе кислорода. Это связывание происходит в присутствии гема, группы гемоглобина, которая связывает молекулу кислорода.
Четвертичная структура гемоглобина является важным фактором его функциональности. Она определяет возможность связывания и переноса кислорода, а также обеспечивает устойчивость молекулы к разрушению.
Влияние четвертичной структуры на функции гемоглобина

Четвертичная структура гемоглобина обеспечивает связывание и транспортировку кислорода. Когда молекула Hb связывает кислород в легких, происходит конформационное изменение в четвертичной структуре, которая способствует более эффективному связыванию кислорода другими подъединицами.
Однако, изменение четвертичной структуры может также влиять на растворимость гемоглобина. Некоторые генетические мутации, такие как сицианемия и альфа-талассемия, могут привести к изменению структуры гемоглобина и его неправильному складированию в клетках. Это может привести к развитию гемолитических заболеваний и анемии.
Кроме того, изменения в четвертичной структуре могут повлиять на изменение аффинности между гемоглобином и кислородом. Например, режимы закисления и дезакисления могут изменить пространственную конформацию гемоглобина и его способность кислорода кислород.
В целом, четвертичная структура гемоглобина является критическим фактором, определяющим его функции. Одно изменение в структуре может иметь серьезные последствия для кислородного транспорта и образования эритроцитов.



