В химии существует два понятия, которые часто приводят к путанице - молярная масса и молекулярная масса. Эти термины имеют сходное значение, но отличаются друг от друга. Понимание разницы между ними играет важную роль в химических расчетах и определении свойств веществ.
Молекулярная масса - это сумма атомных масс в молекуле вещества. Она определяется по формуле вещества и выражается в атомных единицах массы, которые обозначают с помощью молекулярного веса. Молекулярная масса является важным показателем химических свойств вещества и используется для расчета массы молекулы, молярных долей и других параметров.
С другой стороны, молярная масса - это масса одного моля вещества. Она измеряется в г/моль и обозначается символом "М". Молярная масса является физической характеристикой вещества и позволяет провести сравнительные расчеты и определить количество вещества, содержащееся в данном объеме или массе.
Молярная масса: что это?

Молярная масса величины химических веществ имеет важное значение при проведении различных расчетов в химии. Она позволяет определить количество вещества, выраженное в молях, по его массе, и наоборот. Молярная масса также является ключевым показателем при изучении реакций между веществами.
Пример: Молярная масса молекулы воды (H2O) составляет примерно 18 г/моль. Это означает, что одна моль воды имеет массу около 18 г. Если у нас есть 36 г воды, мы можем определить, сколько молей воды содержится в данном количестве путем деления массы на молярную массу: 36 г / 18 г/моль = 2 моль.
Молярную массу вещества можно определить, зная атомные массы его составляющих атомов или молекул. Для этого необходимо умножить массу каждого атома или молекулы на их количество в формуле вещества, а затем сложить полученные значения.
Определение и применение
Молекулярная масса, в свою очередь, представляет собой сумму атомных масс каждого элемента, участвующего в молекуле. Она может быть вычислена путем сложения атомных масс элементов, умноженных на их количество в молекуле.
Разница между молярной массой и молекулярной массой заключается в том, что молярная масса отражает массу одной молекулы вещества, а молекулярная масса - суммарную массу всех атомов в молекуле.
Молярная масса и молекулярная масса являются важными понятиями в химии и имеют широкое применение. Они используются для расчета количества вещества в реакциях, определения стехиометрии реакций, а также для вычисления массы растворенных веществ в растворах.
Знание молярной массы и молекулярной массы помогает химикам понять свойства вещества, его реакционную способность, а также способность образовывать стабильные молекулы.
Как измеряется
Для определения молярной массы можно использовать следующие методы:
- Использование гравиметрических методов, основанных на взвешивании вещества.
- Применение количественного анализа химических реакций, в которых известны массы веществ и их стехиометрические соотношения.
- Использование физических методов, таких как диффузия газов или определение плотности вещества.
Для определения молекулярной массы можно использовать следующие методы:
- Применение масс-спектрометрии, которая позволяет определить массу молекулы путем измерения разделения молекул по массе.
- Использование методов оптической спектроскопии, таких как инфракрасная или ультрафиолетовая спектроскопия.
- Применение метода рентгеноструктурного анализа, позволяющего определить атомную структуру молекулы и, следовательно, ее массу.
Выбор метода измерения молярной или молекулярной массы зависит от химического вещества и доступных экспериментальных техник. Комбинация различных методов может быть использована для повышения точности и достоверности полученных данных.
Молекулярная масса: что это?

Молекулярная масса выражается в атомных единицах массы (а.е.м.) и обозначается как М. Например, молекулярная масса воды (Н2О) равна 18,02 а.е.м.
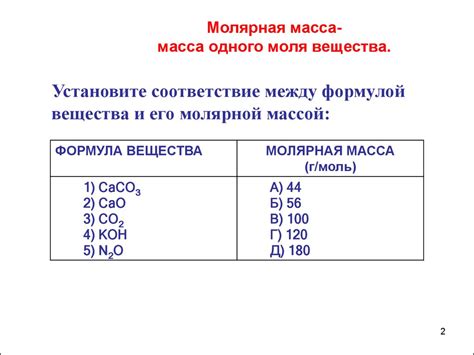
Для определения молекулярной массы необходимо знать химический состав вещества, то есть количество и типы атомов, входящих в его молекулу. Каждому типу атома присваивается атомная масса, которая указывается в таблице Менделеева.
| Элемент | Символ | Атомная масса, а.е.м |
|---|---|---|
| Водород | H | 1,008 |
| Кислород | O | 16,00 |
| Углерод | C | 12,01 |
| Азот | N | 14,01 |
| ... | ... | ... |
Пример расчета молекулярной массы: для воды (Н2О) учитываем, что в молекуле содержится 2 атома водорода и 1 атом кислорода. Суммируя атомные массы, получим:
М (Н2О) = 2 * 1,008 + 16,00 = 18,02 а.е.м.
Молекулярная масса имеет большое значение при проведении химических расчетов, так как она позволяет определить количество вещества в молекуле и использовать его в дальнейших расчетах. Также она является основой для определения других характеристик вещества, например, концентрации и плотности.
Определение и применение

Молярная масса широко используется в химии и физике. На основе молярной массы можно рассчитать количество вещества по массе или массу по количеству вещества, используя уравнение:
масса = количество вещества * молярная масса
Количество вещества измеряется в молях (моль), которое является стандартной единицей количества вещества. Молярная масса позволяет проводить расчеты в химических реакциях, определять долю компонента в смеси и проводить другие расчеты, связанные с количеством вещества.
Молекулярная масса (m) является массой одной молекулы вещества и измеряется в атомных единицах массы (указывается в таблице Менделеева). Молекулярная масса может быть вычислена путем сложения масс атомов в молекуле, умноженных на их коэффициенты в формуле вещества.
| Понятие | Молярная масса | Молекулярная масса |
|---|---|---|
| Определение | Масса одного моля вещества | Масса одной молекулы вещества |
| Единицы измерения | г/моль или кг/моль | u (атомные единицы массы) |
| Используется в | Расчетах по количеству вещества | Расчетах по структуре и свойствам молекулы |
Как измеряется
Молярная масса и молекулярная масса определяются с помощью разных методов и приборов.
Молярная масса измеряется с использованием масс-спектрометра. Масс-спектрометр - это прибор, который позволяет анализировать химические смеси и определять массу атомов и молекул. При использовании масс-спектрометра, образец вводится в прибор, где происходит его ионизация. Затем ионы разделяются по массе ионов и регистрируются детектором. Измерение массы основывается на соотношении заряда и массы иона.
Молекулярная масса, с другой стороны, измеряется с использованием масс-спектрометра и масс-спектрометра с преобразованием Фурье (FT-MS). FT-MS - это разновидность масс-спектрометра, в котором быстрое преобразование Фурье применяется для анализа ионов. Этот метод позволяет более точно определить молекулярную массу ионов, включая массу атомов, входящих в молекулу.
Таким образом, молярная масса и молекулярная масса измеряются с помощью специализированных приборов и методов, которые позволяют определить массу атомов и молекул. Эти измерения являются важными для химических исследований и позволяют установить состав и структуру различных веществ.
Разница между молярной и молекулярной массой
Молекулярная масса, с другой стороны, является массой одной молекулы вещества. Она измеряется в атомных единицах массы (u). Молекулярная масса может быть получена путем сложения масс атомов в молекуле.
Основное отличие между молярной массой и молекулярной массой состоит в том, что первая является массой одного моля вещества, а вторая - массой одной молекулы вещества.
Молярная масса используется для расчета количества вещества в реакции или веществе, а также для приведения массы вещества к количеству вещества. Молекулярная масса, с другой стороны, используется для определения массы одной молекулы вещества и для расчета стехиометрических соотношений между молекулами вещества.
Оба понятия, молярная и молекулярная масса, имеют важное значение в химии и могут помочь в понимании состава и свойств вещества.
Определение и примеры

Пример 1: Рассмотрим молекулу воды (H2O). Водный молекула состоит из двух атомов водорода (H) и одного атома кислорода (O). Атомарные массы водорода и кислорода составляют соответственно около 1 г/моль и 16 г/моль. Чтобы вычислить молярную массу воды, мы должны сложить массы атомов водорода и кислорода, умноженные на их количество. Таким образом, молярная масса воды будет равна 1 г/моль (масса водорода) + 1 г/моль (масса водорода) + 16 г/моль (масса кислорода) = 18 г/моль.
Пример 2: Рассмотрим молекулу углекислого газа (CO2). Молекула углекислого газа состоит из одного атома углерода (C) и двух атомов кислорода (O). Атомарная масса углерода составляет около 12 г/моль, а атомарная масса кислорода – около 16 г/моль. Поэтому молярная масса углекислого газа будет равна 12 г/моль (масса углерода) + 16 г/моль (масса кислорода) + 16 г /моль (масса кислорода) = 44 г/моль.
Физическое и химическое значение
Физическое значение молярной массы заключается в том, что она позволяет определить количество вещества в системе. Молярная масса выражается в граммах на моль и является пропорциональностью между массой и количеством вещества. Например, для воды молярная масса равна приблизительно 18 г/моль, что означает, что водные молекулы массой в 18 г содержат один моль вещества.
Химическое значение молярной массы состоит в том, что она позволяет проводить расчеты в химических реакциях. Молярная масса вещества определяет количество вещества, которое участвует в реакции или образуется в результате реакции. Например, если в химической реакции участвует водород (H2) и углекислый газ (CO2), то зная их молярные массы, можем определить количество каждого из веществ, необходимое для реакции.
Таким образом, молярная масса имеет физическое значение, связанное с количеством вещества, а также химическое значение, позволяющее проводить расчеты в химических реакциях.
Практическое применение молярной и молекулярной массы

Знание молярной и молекулярной массы важно для различных практических приложений в различных областях науки и промышленности. Вот некоторые из примеров использования этих величин:
1. Химические расчеты: Молекулярная масса позволяет ученым проводить различные химические расчеты, включая стехиометрические расчеты, вычисление количества вещества, объем газов и другие параметры.
2. Синтез органических соединений: Знание молекулярной массы органических соединений позволяет химикам определить правильные пропорции и количества реагентов, необходимых для синтеза нужного соединения. Также молекулярная масса используется для определения выхода продукта реакции.
3. Анализ состава образцов: Знание молярной и молекулярной массы позволяет анализировать состав различных образцов и определять процентное содержание отдельных элементов или соединений в этих образцах. Это важно для определения качества и состава различных материалов.
4. Разработка новых материалов и лекарственных препаратов: Молекулярная масса помогает исследователям разрабатывать новые материалы и лекарственные препараты. Знание молекулярной массы позволяет ученым определить структуру и состав новых соединений, а также предсказать их физико-химические свойства.
5. Определение плотности и концентрации растворов: Молярная масса используется для определения плотности различных жидкостей и концентрации растворов. Это важно для контроля качества продуктов в промышленности, а также в лабораторных исследованиях.
Таким образом, понимание различий и применение молярной и молекулярной массы является важным компонентом работы во многих научных и практических областях. Это помогает химикам, исследователям и инженерам проводить расчеты, синтезировать вещества, анализировать состав материалов и разрабатывать новые продукты и препараты.
Влияние на реакции и формулы

Отличие молярной массы от молекулярной имеет прямое влияние на реакции и формулы соединений.
Молярная масса указывает на массу одного моля вещества и измеряется в г/моль. Молекулярная масса, в свою очередь, относится к массе одной молекулы соединения и также выражается в г/моль.
При использовании молярной массы в химических реакциях, можно легко определить количество вещества, необходимое для проведения реакции. Также, молярная масса позволяет расчеты пропорций между различными компонентами реакционной смеси.
Молекулярная масса соединения необходима для составления и использования химических формул. Она определяет структуру и состав молекулы, что помогает понять ее свойства и поведение в химических реакциях. Молекулярная масса также является основой для расчетов мольных долей элементов в соединении и для определения степени окисления элементов.
Зная разницу между молярной массой и молекулярной массой, химики могут более точно определить количество вещества, провести расчеты и использовать соответствующие формулы для реакций и составления химических соединений.
Определение стехиометрических соотношений

Основной инструмент для определения стехиометрических соотношений - уравнения реакций. В уравнении реакции указываются исходные вещества, продукты реакции и их коэффициенты. Коэффициенты показывают, в каких пропорциях реагируют вещества.
Например, уравнение реакции сгорания метана выглядит следующим образом:
| CH4 + 2O2 | = | CO2 + 2H2O |
Из уравнения видно, что 1 молекула метана (CH4) реагирует с 2 молекулами кислорода (O2) и образует 1 молекулу углекислого газа (CO2) и 2 молекулы воды (H2O). Такое соотношение между веществами позволяет определить количество каждого вещества, участвующего в реакции.
Стехиометрические соотношения также позволяют вычислить массу вещества, исходя из мольного количества. Для этого необходимо знать молярную массу каждого вещества и использовать соответствующие пропорции.



